题目内容
9.钛铁矿是铁和钛的氧化物矿物,成分可表示为FeTiO3 (Ti为+4价).钛白粉(TiO2)涂料、塑料、油墨、造纸行业具有广泛的用途,制备流程如图:
(1)钛铁矿与硫酸反应时可表示为FeTiO3+H2SO4→TiOSO4+X+H2O.其中X的化学式为FeSO4.该反应为氧化还原反应 (填“氧化还原反应”或“非氧化还原反应”).
(2)某钛铁矿中FeTiO3的含量为76%,该钛铁矿与硫酸反应时Ti转化率为92%,操作I到操作IV的过程中Ti的转化率为96%,则1t该钛铁矿可生产钛白粉0.35t (所有计算结果保留两位有效数字),能否计算绿矾的产量在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量?(若能则计算数值,否则说明理由).
(3)操作I的名称是过滤,操作II包括搅拌、结晶、过滤.操作II中加入铁粉的目的是Fe+2Fe3+═3Fe2+(用离子方程式表示).
(4)写出操作III中TiOSO4水解的化学方程式:TiOSO4+2H2O═TiO(OH)2↓+H2SO4.
(5)该生产过程中产生的尾气SO2、SO3的处理方法是用碱液吸收.
分析 (1)根据原子守恒可以得而X的化学式,存在元素的化合价改变的反应为氧化还原反应;
(2)则根据元素守恒得:FeTiO3~TiO2,根据FeTiO3的质量1t×76%×92%×96%,来计算二氧化钛的质量;在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量;
(3)从溶液中得到了没有与酸反应的颗粒状物质故所需的操作为过滤;从溶液中得到晶体的操作为结晶后过滤;铁粉与可能生成的+3价的铁反应生成+2价的铁;
(4)根据水解原理:TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-来书写方程式;
(5)因SO2、SO3是酸性氧化物,可以和碱液之间反应,据此回答.
解答 解:钛铁矿与硫酸反应:FeTiO3+H2SO4→TiOSO4+FeSO4+H2O,然后过滤出未被酸溶解的物质,将所得到的滤液中加入铁粉可以得到了绿矾,将滤液控制在一定的条件,让TiOSO4水解:TiOSO4+2H2O═TiO(OH)2↓+H2SO4,将过滤出的沉淀进行煅烧,可以得到钛白粉(TiO2).
(1)根据原子守恒可以得而X的化学式为FeSO4,在FeTiO3中Ti为+4价故Fe为+2价,反应后铁元素的化合价没有发生改变,钛元素化合价也没有发生改变,其他元素的化合价都没发生改变,故此反应为非氧化还原反应.
故答案为:FeSO4;氧化还原反应;
(2)设得到二氧化钛的质量是m,则根据元素守恒得:
FeTiO3~TiO2
152 80
1t×76%×92%×96% m
m=0.35t,在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量;
故答案为:0.35;在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量;
(3)在操作I从溶液中得到了没有与酸反应的颗粒状物质故所需的操作为过滤;在操作II加入铁粉后得到了绿矾,故应是从溶液中得到晶体的操作为结晶后过滤;在操作II加入铁粉的目的是为了防止在制备过程中钛铁矿+2价的铁生成+3价的铁使制备的绿矾中含有杂质,故应加入铁粉与可能生成的+3价的铁反应生成+2价的铁,
故答案为:过滤;过滤;Fe+2Fe3+═3Fe2+;
(4)TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-,故反应为:TiOSO4+2H2O═TiO(OH)2↓+H2SO4,
故答案为:TiOSO4+2H2O═TiO(OH)2↓+H2SO4;
(5)因SO2、SO3是酸性氧化物,故应用碱液进行吸收,故答案为:用碱液吸收.
点评 本题考查物质的制备实验方案的设计,题目难度中等,试题侧重于学生的分析能力和实验能力的考查,为高考常见题型,明确制备流程及反应原理为解答关键,注意把握实验的基本原理和常见物质的性质.

 阅读快车系列答案
阅读快车系列答案| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| A. | 乙醇(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
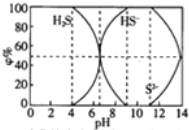
| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Kφ(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
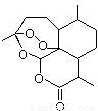
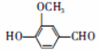 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图:
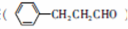 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应: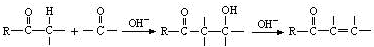
 ?H++HS-和HS-
?H++HS-和HS-
 .
.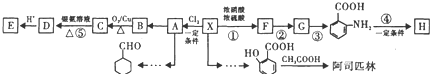
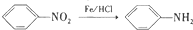 (苯胺、易被氧化)
(苯胺、易被氧化)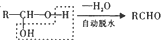
 ;
;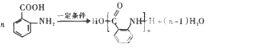 ;
;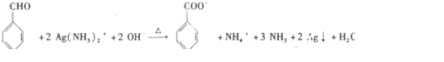 .
.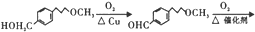 完成
完成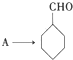 的流程图
的流程图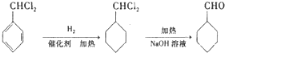 ;
; Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应
Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应