题目内容
【题目】已知:25℃时,H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7 H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10-11 HClO Ka=3.0×10﹣8 饱和 NaClO 溶液的浓度约为 3mol/L.
(1)室温下,0.1mol/L NaClO 溶液的 pH _____0.1mol/L Na2SO3 溶液的 pH.(选填“大于”、小于”或“等于”)。浓度均为 0.1mol/L 的 Na2SO3 和 Na2CO3 的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为_______________。
(2)下列离子反应正确的有:__________。
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为 NaClO,还含有一定量的 NaOH 等,下列用来解释事实的方程式中不合理的是:__________。
A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的 pH 约为12,主要是因为:ClO﹣+H2O![]() HClO+OH﹣
HClO+OH﹣
C.该消毒液加白醋生成 HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol 下列气体分别与 1L0.l mol·L﹣1 的 NaOH 溶液反应,形成的溶液的pH 由大到小的顺序为:_________(用 A、B、C 表示).
A.SO3 B.SO2 C.CO2
(5)下列说法不正确的是(_____)
A.一定温度下,pH相同的氨水和氢氧化钠等体积混合后溶液pH不变
B.含等物质的量的 NaClO、NaHCO3 混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH 溶液加水稀释后,溶液中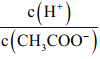 的值减小
的值减小
D.水中加入金属钠,虽反应生成了强碱氢氧化钠,但促进了水的电离
【答案】 大于 c(SO32﹣)>c(CO32﹣)>c(HCO3﹣)>c(HSO3﹣) B B C C>B>A C
【解析】(1)根据盐类水解中越弱越水解,同时电离平衡常数越大,越促进电离,因此NaClO的碱性强于Na2SO3,填“大于”,越弱越水解,电离平衡常数越小,说明电离能力越小,因此CO32-水解能力强于SO32-,且水解程度非常微弱,因此离子浓度大小c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);(2)利用电离程度强的制取电离程度弱的,A、H2SO3的第二步电离常数小于H2CO3的第一步,因此HCO3-+SO2=HSO3-+CO2↑,选项A错误;B、H2CO3的第二步电离常数小于HClO的,因此ClO-+CO2+H2O=HClO+HCO3-,选项B正确;C、因为次氯酸具有强氧化性,把+4S氧化成+6价,选项C错误;D、因为次氯酸具有强氧化性,把+4S氧化成+6价,选项D错误;答案选B;(3)A、氯气和氢氧化钠反应,生成NaCl、NaClO,故说法正确;B、消毒液pH=12,原因是含有一定量的NaOH,故说法错误;C、白醋是弱酸,不能拆写成离子,故说法错误;D、存在中间价态,因此有ClO-+Cl-+2H+=Cl2↑+H2O,故说法正确;答案选BC;(4)A、硫酸过量,浓度为0.05mol·L-1;B、生成NaHSO3;C生成NaHCO3;越弱越水解,水解程度:HCO3->HSO3-,因此碱性强弱:C>B>A;(5)A、两种碱的pH相同,等体积混合因此所得混合液的pH不变,选项A正确;B、根据物料守恒,c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3),选项B正确;C、加水稀释促进电离,H+和CH3COO-量相等,即比值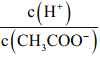 不变,选项C错误;D、向水中投入一小块金属钠,Na和水反应生成NaOH,NaOH抑制水电离,但溶液呈碱性,选项D错误;答案选C。
不变,选项C错误;D、向水中投入一小块金属钠,Na和水反应生成NaOH,NaOH抑制水电离,但溶液呈碱性,选项D错误;答案选C。