题目内容
【题目】为探索工业中铝、铁、铜的合金废料的再利用,某同学设计了如下回收方案:
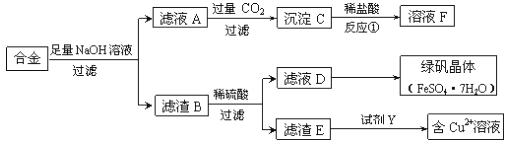
(1)操作①的名称是______________,滤渣B含有_______________(填化学式)。
(2)反应①的离子方程式是_________________________________。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作是______________、冷却结晶、过滤、自然干燥,这一系列操作中没有用到的仪器有________(填序号)。
A.漏斗 B.坩埚 C.烧杯 D.玻璃棒
(4)试剂Y应该是一种________(填“氧化剂”或“还原剂”),它不可能是____(填序号)。
A.过氧化氢 B.氢气 C.氧气 D.铁
【答案】过滤Fe、CuCO2+AlO2-+2H2O=HCO3-+Al(OH)3↓蒸发浓缩B氧化剂BD
【解析】
Al和NaOH溶液反应生成可溶性的NaAlO2,Cu和Fe与NaOH溶液不反应,所以滤液A中含有NaAlO2,滤渣B是Cu和Fe,B和稀硫酸混合,Fe和稀硫酸反应生成FeSO4,Cu和稀硫酸不反应,所以滤渣E是Cu,D中含有FeSO4,Cu和稀硫酸、试剂Y生成硫酸铜,Y是强氧化剂,且不能引进新的杂质,为H2O2,A(NaAlO2)与过量的气体X反应生成沉淀C,沉淀C与盐酸反应生成溶液F,因此X为CO2,反应生成Al(OH)3,所以C是Al(OH)3,Al(OH)3和稀盐酸反应生成AlCl3,溶液F中含有AlCl3。
(1)根据上述分析,操作①为过滤,滤渣B中含有Fe、Cu,故答案为:过滤;Fe、Cu;
(2)反应①为偏铝酸钠和过量二氧化碳的反应,反应的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:蒸发浓缩、冷却结晶、过滤、自然干燥,在这一系列操作中用蒸发皿蒸发、用玻璃棒搅拌,在过滤中用玻璃棒引流、用烧杯盛放溶液,所以没有用到的仪器有坩埚,故选B,故答案为:蒸发浓缩;B;
(4)试剂Y应该是一种氧化剂,能将铜氧化为铜离子,所以它不可能是H2或Fe,故选BD,故答案为:氧化剂;BD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是 ( )
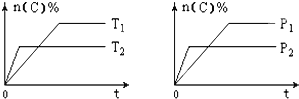
A. P1 > P2
B. 该反应的ΔH < 0
C. 化学方程式系数a>c+d
D. 使用催化剂,C的物质的量分数增加
【答案】B
【解析】A.先拐先平数值大,由右图可知,P2>P1,故A错误;B. 先拐先平数值大,由左图可知,T2>T1,升高温度C的物质的量分数减小,说明升高温度平衡逆向移动,则该反应为放热反应,ΔH < 0,故B正确;C. 由右图可知,P2>P1,增大压强C的物质的量分数减小,说明增大压强平衡逆向移动,则逆反应方向为气体体积减小的方向,所以化学方程式系数a<c+d,故C错误;D. 使用催化剂不能使化学平衡发生移动,则C的物质的量分数不变,故D错误;答案选B。
【题型】单选题
【结束】
22
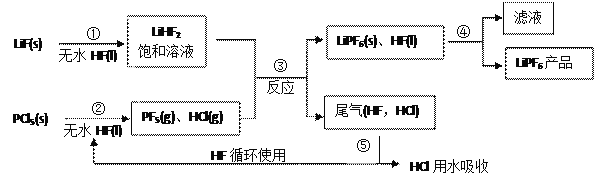
【题目】25℃时,0.1 molL-1溶液的pH如下表,下列有关说法正确的是 ( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A. 酸性强弱:HF<H2CO3
B. ①和②中溶质均未水解
C. 由水电离产生的c(H+):①>②
D. ④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)= c(Na+)