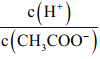��Ŀ����
����Ŀ��A��B��C��D��E��F��GΪ7�ֶ���������Ԫ�أ���ԭ��������������A��C���γ�A2C��A2C2���ֻ����B����������ϼ���������ϼ۵ľ���ֵ֮��Ϊ2��D��Aͬ���壬E�ǵؿ��к�����ߵĽ���Ԫ�أ�F��Cͬ�����ҿ��γ�FC2��FC3���ֻ����
��1��G��Ԫ��������__________������Ԫ�����ڱ��е�λ����______________��
��2��F������������������ȣ�F��ԭ����ɷ���Ϊ______���������Ϊ____�ۡ�
��3��C��D���γ�һ�ֵ���ɫ���廯���д���˻�����ĵ���ʽ__________��
��4��������7��Ԫ���е�4��Ԫ����ɵĻ�����X��X�������ȵ�NaOH��Һ��Ӧ��Ҳ����ϡ���ᷴӦ���Ҿ���������ɫ���壬X�Ļ�ѧʽ��____________________��
��5����֪Se�ڵ������ڣ���Sͬ���壬������д��һ�ֺ�Se���ʵĻ�ѧʽ��Ԥ�������ʣ���˵��Ԥ������_______��
��Se���ʻ�ѧʽ | ���� | Ԥ������ |
���𰸡��� ����������A��3216S+6![]() ��NH4��2SO3��NH4HSO3
��NH4��2SO3��NH4HSO3
��ѧʽ | ���� | ���� |
Se | �������Ӧ/��������Ӧ/��������Ӧ | �������ڱ��е�λ�ã��ж�SeΪ�ǽ��������ܾ��зǽ�����ͨ�� |
H2Se | ��H2S���ȶ����� | Se��S����ͬһ���壬��λ��SԪ�ص���һ���ڣ��ǽ����Ա�S�����ɴ��Ƴ���̬�⻯����ȶ���Ҳ���� |
SeO2 ��SeO3�� | ��Ӧ/���������ﷴӦ | �������ڱ��е�λ�ã��ж�SeΪ�ǽ�������Ӧ��SeO2Ϊ������������ܾ�������������ͨ�ԡ� |
H2SeO4 | ��Ӧ������������ﷴӦ����ijЩ������Ӧ����ijЩ�η�Ӧ ���ԣ�H3SeO4��H2SO4 | �������ڱ��е�λ�ã��ж�SeΪ�ǽ�������Ӧ��H2SeO4Ϊ�ᣬ���ܾ������ͨ�ԡ� Se��S����ͬһ���壬��λ��SԪ�ص���һ���ڣ����ԣ�H2SeO4��H2SO4 |
H2SeO3 | ��Ӧ������������ﷴӦ����ijЩ������Ӧ����ijЩ�η�Ӧ | �������ڱ��е�λ�ã��ж�SeΪ�ǽ�������Ӧ��H2SeO4Ϊ�ᣬ���ܾ������ͨ�ԡ� |
������һ����
��������
A��B��C��D��E��F��GΪ7�ֶ���������Ԫ�أ���ԭ����������������E�ǵؿ��к�����ߵĽ���Ԫ�أ���EΪAlԪ�أ�B����������ϼ���������ϼ۵ľ���ֵ֮��Ϊ2������������Ϊ5��ԭ������С��������BΪNԪ�أ�A��C���γ�A2C��A2C2���ֻ������AΪHԪ�ء�CΪOԪ�أ�D��Aͬ���壬D��ԭ����������������DΪNaԪ����F��Cͬ�����ҿ��γ�FC2��FC3���ֻ������FΪSԪ�أ�G��ԭ���������GΪClԪ�أ��ݴ˽��
��������������AΪHԪ�أ�BΪNԪ�أ�CΪOԪ�أ�DΪNaԪ�أ�EΪAlԪ�أ�FΪSԪ�أ�GΪClԪ�ء�
(1)GΪClԪ�أ�����Ϊ�ȣ���Ԫ�����ڱ���λ�ڵ������ڢ�A�壬�ʴ�Ϊ���ȣ��������ڢ�A�壻
(2)FΪSԪ�أ�����������������ȵ�ԭ�ӵ�������Ϊ16+16=32��ԭ�ӷ���Ϊ3216S����ԭ���������6�����ӣ����Ϊ+6�ۣ��ʴ�Ϊ��3216S��+6��
(3)C��D�γɵ�һ�ֵ�ɫ���廯����Ϊ�������ƣ�����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)������7��Ԫ���е�4��Ԫ����ɻ�����X��X�������ȵ�NaOH��Һ��Ӧ��Ҳ����ϡ���ᷴӦ���Ҿ���������ɫ���壬��XΪ(NH4)2 SO3��NH4HSO3���ʴ�Ϊ��(NH4)2 SO3��NH4HSO3��
(5)��ԭ�Ӻ˵����Ϊ34��ԭ�Ӻ����ĸ����Ӳ㣬��������6����ԭ�ӽṹʾ��ͼΪ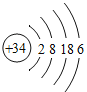 �����Ļ�����ΪH2Se��SeO2��SeO3��H2SeO4��H2SeO3��Na2SeO3��Na2SeO4��������Ԥ�����±���ʾ��
�����Ļ�����ΪH2Se��SeO2��SeO3��H2SeO4��H2SeO3��Na2SeO3��Na2SeO4��������Ԥ�����±���ʾ��
��ѧʽ | ���� | ���� |
Se | �������Ӧ/��������Ӧ/��������Ӧ | �������ڱ��е�λ�ã��ж�SeΪ�ǽ��������ܾ��зǽ�����ͨ�� |
H2Se | ��H2S���ȶ����� | Se��S����ͬһ���壬��λ��SԪ�ص���һ���ڣ��ǽ����Ա�S�����ɴ��Ƴ���̬�⻯����ȶ���Ҳ���� |
SeO2 (SeO3) | ��Ӧ/���������ﷴӦ | �������ڱ��е�λ�ã��ж�SeΪ�ǽ�������Ӧ��SeO2Ϊ������������ܾ�������������ͨ�ԡ� |
H2SeO4 | ��Ӧ������������ﷴӦ����ijЩ������Ӧ����ijЩ�η�Ӧ ���ԣ�H3SeO4��H2SO4 | �������ڱ��е�λ�ã��ж�SeΪ�ǽ�������Ӧ��H2SeO4Ϊ�ᣬ���ܾ������ͨ�ԡ� Se��S����ͬһ���壬��λ��SԪ�ص���һ���ڣ����ԣ�H2SeO4��H2SO4 |
H2SeO3 | ��Ӧ������������ﷴӦ����ijЩ������Ӧ����ijЩ�η�Ӧ | �������ڱ��е�λ�ã��ж�SeΪ�ǽ�������Ӧ��H2SeO4Ϊ�ᣬ���ܾ������ͨ�ԡ� |
�ʴ�Ϊ��
��ѧʽ | ���� | ���� |
Se | �������Ӧ/��������Ӧ/��������Ӧ | �������ڱ��е�λ�ã��ж�SeΪ�ǽ��������ܾ��зǽ�����ͨ�� |
H2Se | ��H2S���ȶ����� | Se��S����ͬһ���壬��λ��SԪ�ص���һ���ڣ��ǽ����Ա�S�����ɴ��Ƴ���̬�⻯����ȶ���Ҳ���� |
SeO2 (SeO3) | ��Ӧ/���������ﷴӦ | �������ڱ��е�λ�ã��ж�SeΪ�ǽ�������Ӧ��SeO2Ϊ������������ܾ�������������ͨ�ԡ� |
H2SeO4 | ��Ӧ������������ﷴӦ����ijЩ������Ӧ����ijЩ�η�Ӧ ���ԣ�H3SeO4��H2SO4 | �������ڱ��е�λ�ã��ж�SeΪ�ǽ�������Ӧ��H2SeO4Ϊ�ᣬ���ܾ������ͨ�ԡ� Se��S����ͬһ���壬��λ��SԪ�ص���һ���ڣ����ԣ�H2SeO4��H2SO4 |
H2SeO3 | ��Ӧ������������ﷴӦ����ijЩ������Ӧ����ijЩ�η�Ӧ | �������ڱ��е�λ�ã��ж�SeΪ�ǽ�������Ӧ��H2SeO4Ϊ�ᣬ���ܾ������ͨ�ԡ� |

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���� 1.0 L �ܱ������з��� 0.10molA(g)����һ���¶Ƚ������·�Ӧ��A(g)![]() 2B(g)��C(g)+D(s) ��H= +85.1kJ��mol��1��������������ѹǿ(P)����ʼѹǿ P0 �ı�ֵ�淴Ӧʱ��(t)���ݼ��±���
2B(g)��C(g)+D(s) ��H= +85.1kJ��mol��1��������������ѹǿ(P)����ʼѹǿ P0 �ı�ֵ�淴Ӧʱ��(t)���ݼ��±���
ʱ�� t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P /P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
�ش���������:
��1����ƽ�ⳣ���ı���ʽΪ_____________��
��2����������� A ��ת���ʵ���________��
A�������¶� B����ϵ��ͨ�� A ���� C���� D ��Ũ�ȼ�С
D��ͨ��ϡ������ He��ʹ��ϵѹǿ����ԭ���� 5 ��
E������ϵ�е� C Ϊ HCl���������ʾ�������ˮ����������ˮ
��3��ǰ 2Сʱ C �ķ�Ӧ������___________ mol��L-1��h-1��
��4��ƽ��ʱ A ��ת����___________ C ���������_________����������λ��Ч���֣�