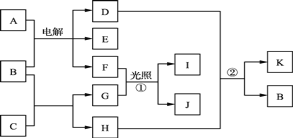
题目内容
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
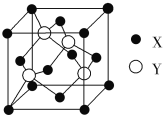
①在1个晶胞中,X离子的数目为________。
②该化合物的化学式为________。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_________。
(3)Y与Z可形成YZ42-,YZ42-的空间构型为________(用文字描述)。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
(5)请比较亚氯酸(HClO2)和氯酸(HClO3)的酸性强弱:HClO2________HClO3(填“>”“<”或“=”),试从分子结构与性质的关系解释原因_______ 。
【答案】4 ZnS 水分子与乙醇分子之间形成氢键 正四面体 16NA或16×6.02×1023个 < HClO2和HClO3可以分别表示为(HO)ClO和(HO)ClO2,HClO3分子中非羟基氧原子的数目大于HClO2分子中非羟基氧原子的数目,故HClO3分子中Cl的正电荷更高,导致-O-H中的电子更向Cl偏移,因而在水分子作用下,更易电离出H+,即酸性更强(只要答出HClO3分子中非羟基氧原子的数目多,分子中Cl的正电荷更高即可给分)
【解析】
元素X位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,则X为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,然后根据问题分析解答。
根据上述分析可知X是Cu元素,Y是S元素,Z是O元素。
(1)①X离子位于晶胞的顶点和面心,则在1个晶胞中,含有的X离子数目=8×![]() +6×
+6×![]() =4;
=4;
②该晶胞中X离子数目8×![]() +6×
+6×![]() =4;Y离子位于晶胞内,离子数目=4,所以X和Y离子数目之比等于4:4=1:1,故该化合物的化学式为ZnS;
=4;Y离子位于晶胞内,离子数目=4,所以X和Y离子数目之比等于4:4=1:1,故该化合物的化学式为ZnS;
(2)在乙醇的水溶液中,水分子和乙醇分子之间易形成氢键,氢键的存在导致其溶解性增大而H2O与H2S分子间无氢键形成,因此溶解度较小;
(3)SO42-中价层电子数=4+![]() ×(6+24×2)=4,且S原子上没有孤电子对,所以SO42-呈正四面体结构;
×(6+24×2)=4,且S原子上没有孤电子对,所以SO42-呈正四面体结构;
(4)在[Zn(NH3)4]Cl2中含有4个配位体NH3,4个配位体NH3的N原子与中心离子Zn2+形成4个配位键,配位键属于σ键;在每个配位体中含有3个N-H共价键,共价键也属于σ键,因此每1 mol配合物[Zn(NH3)4]Cl2中含有的σ键数目为:(3×4+4) mol×NA/mol=16 NA;
(5)HClO2和HClO3都是一元酸,可以分别表示为(HO)ClO和(HO)ClO2,HClO3分子中非羟基氧原子的数目大于HClO2分子中非羟基氧原子的数目,故HClO3分子中Cl的正电荷更高,导致-O-H中的共用电子对更向Cl偏移,因而在水分子作用下,更易电离出H+,即溶液的酸性更强。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。
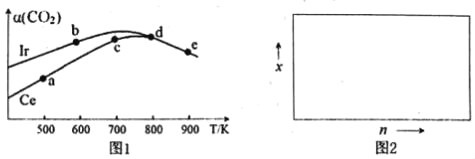
①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______