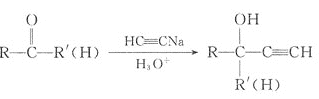
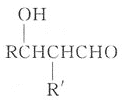
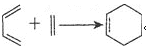
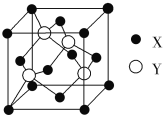
题目内容
【题目】常温下,下列有关叙述正确的是( )
A.Na2CO3溶液中:c(Na+)=2[c(CO32-)+c(HCO3-)]
B.pH相等的①NH4NO3 ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序①>②>③
C.NaY溶液的pH=8,c(Na+)-c(Y-)=9.9×10-7mol/L
D.向0.1mol/L的氨水中加入少量的硫酸铵固体,溶液中![]() 增大
增大
【答案】C
【解析】
A、Na2CO3溶液中的物料守恒为:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],故A错误;
B、pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,NH4HSO4电离出H+,NH4+浓度最小,NH4NO3和(NH4)2SO4水解程度相同,正确顺序为①=②>③,故B错误;
C、NaY溶液的pH=8可知,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,NaY溶液中电荷守恒:c(Na+)+c(H+)=c(Y-)+c(OH-),即c(Na+)- c(Y-)= c(OH-)- c(H+)= 10-6mol/L-10-8mol/L=9.9×10-7mol/L,故C正确;
D、氨水中加入少量的硫酸铵固体,c(NH4+)增大,且温度不变,则Kb不变,故![]() =
=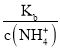 减小,故D错误。
减小,故D错误。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】根据下列事实得出的结论正确的是( )。
选项 | 事实 | 结论 |
A | 甲、乙两种有机物具有相同的相对分子质量和不同的结构 | 甲和乙一定互为同分异构体 |
B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中, |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间后取出部分水解液,滴加银氨溶液后再加热,无银镜出现 | 淀粉的水解产物不具有还原性 |
D | 不存在两种邻二甲苯 | 苯分子中的碳碳键完全相同,苯不是单双键交替结构 |
A.AB.BC.CD.D