题目内容
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。
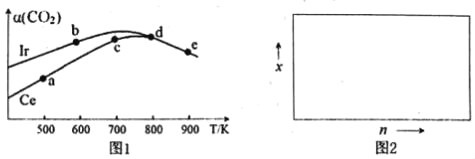
①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
【答案】CO32﹣ CO2+2e﹣═CO+O2﹣、H2O+2e﹣=H2+O2﹣ +247.3 BC ![]() 或23.15
或23.15 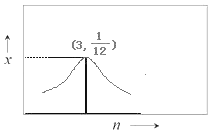
【解析】
(一)(1)K2=![]() =5×10﹣11,当溶液的pH=13,c(H+)=10-13,有
=5×10﹣11,当溶液的pH=13,c(H+)=10-13,有![]() =
=![]() =500,即c(CO32﹣)>>c(HCO3﹣);
=500,即c(CO32﹣)>>c(HCO3﹣);
(2)电解池中,根据O2-移动方向可知:A电极为阴极,该电极上发生还原反应,CO2、H2O分别在A极得到电子发生还原反应生成CO、H2,同时生成O2-;
(二)(1)写出H2、CO、CH4燃烧热的热化学方程式:①H2(g)+![]() O2(g)=H2O(g)△H=﹣285.8kJmol﹣1、②CO(g)+
O2(g)=H2O(g)△H=﹣285.8kJmol﹣1、②CO(g)+![]() O2(g)=CO2(g)△H=﹣283.0kJmol﹣1、③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3kJmol﹣1,再利用盖斯定律求出CH4(g)H+CO2(g)=2CO(g)+2H2(g)的△H1;
O2(g)=CO2(g)△H=﹣283.0kJmol﹣1、③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3kJmol﹣1,再利用盖斯定律求出CH4(g)H+CO2(g)=2CO(g)+2H2(g)的△H1;
(2)①A.反应2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)正向是体积减小的反应,△S<0;由图1可知,状态d是用Ce作催化剂的平衡状态,随着温度的升高,反应物CO2的转化率降低,说明反应正向放热;
B.催化剂能降低反应物的活化能,加快反应速率,使可逆反应快速达到平衡,用Ce作催化剂时,CO2的转化率小、且比用Ir作催化剂后达到平衡,即反应速率小;
C.状态d是使用两种催化剂时一定温度下,某一时刻的平衡状态,反应速率不变;
D.状态b到d是用Ir作催化剂的平衡体系,平衡状态d相对开始平衡(750℃左右)时,α(CO2)减小主要由温度影响,可能平衡逆向移动;
②α(CO2)=50%,则c(CO2)的变化量为0.2mol·L-1×50%=0.1mol·L-1,利用三段式列式,求出平衡量,再求出平衡常数k;
③H2和CO2的物质的量之比为n:1,随着H2的增加,即H2和CO2的物质的量之比增大,平衡体系中CO2的转化率增大,二甲醚的物质的量分数x也增大,当n:1=6:2=3:1时,x值最大;当n:1>3:1时,x值逐渐减小;当n=3时,x=1/12。
(一)(1)K2=![]() =5×10﹣11,当溶液的pH=13,c(H+)=10﹣13,有
=5×10﹣11,当溶液的pH=13,c(H+)=10﹣13,有![]() =
=![]() =500,即c(CO32﹣)>>c(HCO3﹣),所以该溶液中含碳粒子以阴离子CO32﹣为主;
=500,即c(CO32﹣)>>c(HCO3﹣),所以该溶液中含碳粒子以阴离子CO32﹣为主;
(2)根据电解池中O2﹣移动方向推断:A电极为阴极,该电极上发生还原反应,CO2、H2O分别在A极得到电子发生还原反应生成CO、H2,同时生成O2,所以CO2在A极反应式为:CO2+2e﹣═CO+O2﹣,H2O在A电极反应式为:H2O+2e﹣=H2+O2﹣;
(二)(1)H2、CO、CH4燃烧热的热化学方程式分别为:①H2(g)+![]() O2(g)=H2O(g)△H=﹣285.8kJmol﹣1、②CO(g)+
O2(g)=H2O(g)△H=﹣285.8kJmol﹣1、②CO(g)+![]() O2(g)=CO2(g)△H=﹣283.0kJmol﹣1、③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3kJmol﹣1,再利用盖斯定律、依据总反应有:③﹣2×②﹣2×①,△H1=﹣890.3kJmol﹣1﹣(﹣283.0kJmol﹣1)﹣2×(﹣285.8kJmol﹣1)=+247.3kJmol﹣1;
O2(g)=CO2(g)△H=﹣283.0kJmol﹣1、③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3kJmol﹣1,再利用盖斯定律、依据总反应有:③﹣2×②﹣2×①,△H1=﹣890.3kJmol﹣1﹣(﹣283.0kJmol﹣1)﹣2×(﹣285.8kJmol﹣1)=+247.3kJmol﹣1;
(2)①A.反应2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)正向是体积减小的反应,△S<0;由图1可知,随着温度的升高,反应物CO2的转化率降低,说明平衡逆向移动,逆反应吸热,则反应正向放热,故A正确;
B.催化剂能降低反应物的活化能,使可逆反应快速达到平衡,用Ce作催化剂时,CO2的转化率小、且比用Ir作催化剂后达到平衡,说明用Ir作催化剂时反应物的活化能高、反应速率小,故B错误;
C.状态d是800℃时某一时刻的平衡状态,反应速率不变,v(正)=v(逆),故C错误;
D.用Ir作催化剂的平衡体系,不平衡状态b到d平衡状态,α(CO2)先增大后减小,状态d相对开始平衡(750℃左右)时,α(CO2)减小的主要是温度升高,可能平衡逆向移动,故D正确;
故选:BC;
②α(CO2)=50%,则c(CO2)的变化量为0.2mol/L×50%=0.1mol/L,三段式列式为:
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
初始浓度:0.2 0.6 0 0
变化浓度:0.1 0.3 0.05 0.15
平衡浓度:0.1 0.3 0.05 0.15
K=![]() =
=![]() =
=![]() ≈23.15;
≈23.15;
③H2和CO2的物质的量之比为n:1,随着H2的增加,即H2和CO2的物质的量之比增大,平衡体系中CO2的转化率增大,二甲醚的物质的量分数x也增大,当n:1=6:2=3:1时,x值最大;当n:1>3:1时,x值逐渐减小;当n=3时,x=![]() ;故答案为:
;故答案为: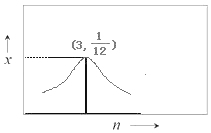 。
。

【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: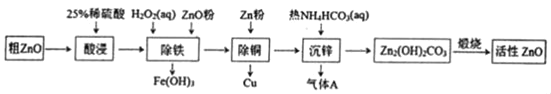
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O