题目内容
【题目】下列关于反应热的说法正确的是 ( )
A.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
B.已知C(s)+![]() O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.当H为“-”时,表示该反应为吸热反应
【答案】A
【解析】
A、盖斯定律认为:化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关,A正确;
B、燃烧热:1mol可燃物完全燃烧生成稳定氧化物放出的热量,碳完全燃烧生成二氧化碳,B错误;
C、反应热的大小即反应物所具有的能量和生成物所具有的能量的差异,C错误;
D、H<0,为放热反应,D错误;
故选A。

【题目】根据下列事实得出的结论正确的是( )。
选项 | 事实 | 结论 |
A | 甲、乙两种有机物具有相同的相对分子质量和不同的结构 | 甲和乙一定互为同分异构体 |
B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中, |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间后取出部分水解液,滴加银氨溶液后再加热,无银镜出现 | 淀粉的水解产物不具有还原性 |
D | 不存在两种邻二甲苯 | 苯分子中的碳碳键完全相同,苯不是单双键交替结构 |
A.AB.BC.CD.D
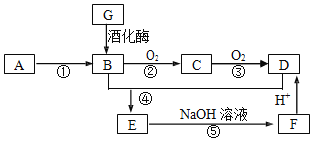
【题目】重铬酸钾(K2Cr2O7)为用途极广的铬化合物,供制铬矾。火柴、铬颜料、并供鞣革、电镀、有机合成等用。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程如图所示:
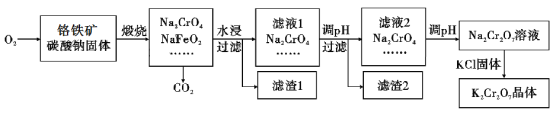
根据题意回答下列问题:
(1)锻烧时,铬铁矿发生复杂反应生成Na2CrO4和NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式是___。
(2)NaFeO2遇水强烈水解生成滤渣l的反应离子方程式是___。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7-8目的是___,滤液2调节pH约为5目的是___。
物质 | 溶解度/(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。此法能够制得K2Cr2O7晶体的原因是:___;为了从溶液中得到较多K2Cr2O7晶体的操作过程是:___、过滤、洗涤、干燥。将得到的K2Cr2O7晶体进一步纯化操作是:___。
(5)K2Cr2O7性质:往K2Cr2O7溶液中加入AgNO3溶液,生成一种砖红色沉淀、溶液的pH减小,反应离子方程式是___。
(6)K2Cr2O7产品含量测定:准确称取试样2.5g配成250mL溶液,用移液管吸取25.00mL溶液放入碘量瓶,加入10mL2mol/L硫酸、2gKI于暗处5min,另加100mL水,用0.2000mol/L Na2S2O3标准液滴定至溶液黄绿色,再加3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。平行三次实验,平均消耗Na2S2O3标准液的体积25.00mL。K2Cr2O7产品的纯度为___。
有关反应如下:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O
2Na2S2O3+I2=Na2S4O6+2NaI
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4