题目内容
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:

已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
(2)“调pH”的目的是__。
(3)“沉降”操作时加入冰水的作用是__。
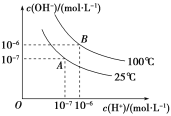
(4)![]() 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
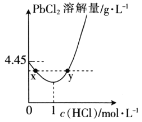
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为__。
【答案】MnO2 +PbS+4HC1![]() PbC12+S+MnC12+2H2O 除去Fe3+ 温度降低,PbC12+2C1-
PbC12+S+MnC12+2H2O 除去Fe3+ 温度降低,PbC12+2C1-![]() PbC142-平衡左移,使PbC142-转化为PbC12,便于析出PbC12晶体(或PbC12难溶于冷水,降低PbC12的溶解度,便于析出PbC12晶体 BD 6.75×10-6mo1L-1 浸取 4PbSO4+6NaOH=3PbOPbSO4H2O+3Na2SO4+2H2O
PbC142-平衡左移,使PbC142-转化为PbC12,便于析出PbC12晶体(或PbC12难溶于冷水,降低PbC12的溶解度,便于析出PbC12晶体 BD 6.75×10-6mo1L-1 浸取 4PbSO4+6NaOH=3PbOPbSO4H2O+3Na2SO4+2H2O
【解析】
方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)中加入稀盐酸,盐酸与MnO2、PbS发生反应生成PbCl2和S,MnO2被还原成Mn2+,加入的NaCl可促进反应PbCl2(s)+2Cl-(aq)PbCl42-(aq)平衡正向移动使更多的Pb元素存在于溶液中;加入Fe2O3溶液调节溶液pH,使铁离子转化成氢氧化铁沉淀除去,然后过滤;PbCl2难溶于冷水,将滤液冷水沉降过滤得到PbCl2晶体,之后加入稀硫酸发生沉淀转化,生成硫酸铅晶体,过滤得到晶体烘干得到硫酸铅粉末,滤液a中主要成分为HCl。
(1)根据题意可知该过程中MnO2将PbS2中的S元素氧化成S单质,锰元素被还原成Mn2+,根据电子守恒和元素守恒可得方程式为MnO2+PbS+4HCl![]() PbCl2+S+MnCl2 +2H2O;
PbCl2+S+MnCl2 +2H2O;
(2)调节pH的主要目的是使Fe3+转化为沉淀,从而除去;
(3)温度降低,PbC12+2C1-![]() PbC142-平衡左移,使PbC142-转化为PbC12,便于析出PbC12晶体(或PbC12难溶于冷水,降低PbC12的溶解度,便于析出PbC12晶体),所以沉降时加入冰水;
PbC142-平衡左移,使PbC142-转化为PbC12,便于析出PbC12晶体(或PbC12难溶于冷水,降低PbC12的溶解度,便于析出PbC12晶体),所以沉降时加入冰水;
(4)PbCl2是微溶化合物,溶于水存在平衡:PbCl2(s)![]() Pb2+(aq)+2Cl-(aq),由图象可知在浓度为1mol/L时溶解量最小;结合题目所给信息可知,小于1mol/L时,主要是电离出的氯离子抑制氯化铅的溶解,大于1mol/L时,可发生PbCl2(s)+2Cl-(aq)
Pb2+(aq)+2Cl-(aq),由图象可知在浓度为1mol/L时溶解量最小;结合题目所给信息可知,小于1mol/L时,主要是电离出的氯离子抑制氯化铅的溶解,大于1mol/L时,可发生PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),而促进溶解。
PbCl42-(aq),而促进溶解。
A.Ksp(PbCl2)只受温度的影响,温度不变,则Ksp(PbCl2)不变,故A错误;
B.根据分析可知x、y两点对应的溶液中的溶质不同,所以c(Pb2+)不相等,故B正确;
C.根据分析可知当盐酸浓度大于1mol/L之后,主要发生反应:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),所以此时c(Pb2+)不一定最小,故C错误;
PbCl42-(aq),所以此时c(Pb2+)不一定最小,故C错误;
D.根据分析可知盐酸浓度小于1mol·L-1时,主要存在平衡PbCl2(s)![]() Pb2+(aq)+2Cl-(aq),氯离子的增多使平衡逆向移动,故D正确;
Pb2+(aq)+2Cl-(aq),氯离子的增多使平衡逆向移动,故D正确;
综上所述选BD;
(5)沉淀转化的方程式为PbCl2(s)+SO42-(aq)PbSO4(s)+2Cl-(aq),该反应的平衡常数K= ,所以当c(Cl-)=0.1mol/L时,c(SO42-)=
,所以当c(Cl-)=0.1mol/L时,c(SO42-)=![]() 6.75×10-6mol/L;
6.75×10-6mol/L;
(6)发生沉淀转化后,滤液a中的主要溶质为HCl,所以经处理后可以返回到浸取工序循环使用;反应物有PbSO4和NaOH,生成中有3PbO·PbSO4·H2O ,根据元素化合价的变化可知该反应不是氧化还原反应,根据元素守恒可得方程式:4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O。