题目内容
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含FeCO3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如图:
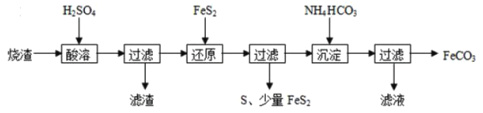
(1)“酸溶”时加快反应速率的方法有____(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___。
②FeS2还原后,检验Fe3+是否反应完全的方法是___。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②能否将NH4HCO3换成(NH4)2CO3___。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g,则Fe2O3的质量为___g。
【答案】加热、增加硫酸的浓度、将烧渣粉碎、搅拌等 FeS2+2Fe3+=3Fe2++2S 取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,未反应完全 Fe(OH)3 能 O2、H2O 21.6
【解析】
⑴“酸溶”时加快反应速率的方法有加热、增加硫酸的浓度、将烧渣粉碎、搅拌等,故答案为加热、增加硫酸的浓度、将烧渣粉碎、搅拌等;
⑵①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,根据流程知,另一个反应中FeS2被氧化成S,另一个反应的离子方程式为:FeS2+2Fe3+=3Fe2++2S,故答案为FeS2+2Fe3+=3Fe2++2S;
②FeS2还原后,检验Fe3+是否反应完全的方法是取少量溶液于试管,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,未反应完全,故答案为取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,未反应完全;
⑶①“沉淀”时,需控制pH不宜过高,pH过高,溶液生成Fe(OH)3,故答案为Fe(OH)3;
②沉淀时主要是向硫酸亚铁溶液中加入碳酸氢铵溶液,发生Fe2+ + 2HCO3- =FeCO3↓+ CO2↑+H2O,将NH4HCO3换成(NH4)2CO3,发生离子反应为Fe2+ + CO32-= FeCO3↓,故答案为能;
⑷FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,红褐色固体为氢氧化铁,同时释放出CO2,则O2、H2O与FeCO3反应方程式:4FeCO3+ O2+ 6H2O =4Fe(OH)3+ 4CO2,故答案为O2、H2O;
⑸煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g,
设氧化铁物质的量为x mol,氧化亚铁物质的量为y mol
则有160x + 72 y = 23.76, ![]() ,解得x = 0.135 ,y = 0.03,即Fe2O3的质量为21.6g,故答案为21.6 g。
,解得x = 0.135 ,y = 0.03,即Fe2O3的质量为21.6g,故答案为21.6 g。