题目内容
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。常温下,用0.01mol·L-1氨水滴定20mL浓度均为0.01mol·L-1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( )
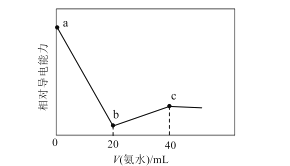
A.a点的混合溶液中c(CH3COO-)约为1.7×10-5mol·L-1
B.b点的混合溶液中:c(CH3COOH)>c(NH4+)
C.c点的混合溶液中:c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH)
D.混合溶液pH=7时,加入氨水体积大于40mL
【答案】B
【解析】
a点为浓度均为0.01mol/L的盐酸和醋酸(1:1)混合溶液,b点溶质为等浓度氯化铵和醋酸,c点溶质为等浓度氯化铵和醋酸铵,根据醋酸的电离平衡常数表达式,电荷守恒,物料守恒分析。
A.a点为浓度均为0.01mol/L的盐酸和醋酸(1:1)混合溶液,盐酸全部电离,醋酸部分电离,根据醋酸的电离平衡表达式: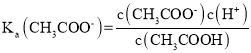 ;可以得到
;可以得到 ,故A正确;
,故A正确;
B.Ka(CH3COOH)=1.7×10-5, ![]() ,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,则c(NH4+)>c(CH3COOH),故B错误;
,Ka(CH3COOH)>Kh(NH4+),醋酸电离程度大于NH4+水解程度,则c(NH4+)>c(CH3COOH),故B错误;
C.点溶液中恰好生成等量的NH4Cl和CH3COONH4,根据物料守恒:2c(Cl)=c(NH4+)+c(NH3H2O),2c(CH3COOH)+2c(CH3COO)=c(NH4+)+c(NH3H2O),c(Cl)=c(CH3COO)+c(CH3COOH),所以有c(NH4+)+c(NH3H2O)=c(Cl)+c(CH3COO)+c(CH3COOH),故C正确;
D.c点溶质为等浓度氯化铵和醋酸铵,Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5,即醋酸的酸性和氨水的碱性相当,在醋酸氨溶液中,铵根离子和醋酸根离子的水解程度相近,溶液呈中性,氯化铵属于强酸弱碱盐,显酸性,要让混合溶液pH=7即中性,加入氨水体积需大于40mL,故D正确;
答案选B。

 智趣暑假温故知新系列答案
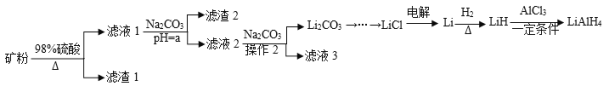
智趣暑假温故知新系列答案【题目】四氢铝锂(LiAlH4)常作为有机合成的重要还原剂。工业上以辉锂矿(主要成分是LiAlSi2O6,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
已知:金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4 |
完全沉淀的pH | 3.7 | 6.5 |
请回答:
(1)写出LiAlSi2O6与硫酸反应的化学方程式__。滤渣2的主要成分为__(填化学式),“a”的最小值为__。
(2)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系如下表所示。操作2中,蒸发浓缩后必须趁热过滤,其原因是__,90℃时Ksp(Li2CO3)的值为__。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(3)流程中由LiC1制备金属Li的电解条件是__。
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应后,收集到标况下气体VmL,
①LiAlH4溶解时发生反应的化学方程式为__。
②样品的纯度为__(列出数学表达式即可)。