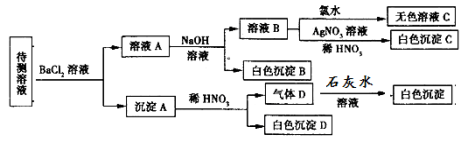
题目内容
【题目】33.6g 含杂质的Na2CO3、NaHCO3均匀混合物平均分成两份,向一份中加入250ml 1.00mol·L-1过量盐酸反应,生成标准状况下3.36L气体。将另一份充分灼烧,干燥后称得固体质量为13.7g。杂质不与酸反应,受热也不分解。求:
(1)原混合物中含有Na2CO3的物质的量。
(2)Na2CO3、NaHCO3的质量比。(写出计算过程)
【答案】0.05;53:84
【解析】试题分析:(1)混合物加热,质量减少33.6g÷2-13.7g=3.1g
设混合物每一份中NaHCO3的质量为m,则:
2NaHCO3![]() Na2CO3+H2O+CO2↑ 固体质量减少
Na2CO3+H2O+CO2↑ 固体质量减少
168 62
m 3.1g
m==8.4g
每一份中碳酸氢钠物质的量为: 0.1mol,每一份与盐酸反应,生成二氧化碳为0.15mol,根据碳元素守恒,每一份中n(Na2CO3)=0.15mol-0.1mol=0.05mol,故原混合物中含有Na2CO3的物质的量为0.05mol×2=0.1mol,答:原混合物中含有Na2CO3的物质的量为0.1mol;(2)Na2CO3、NaHCO3的质量比为0.05mol×106g/mol:8.4g=53:84,
答:Na2CO3、NaHCO3的质量比为53:84.

【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素