题目内容
2.将KO2放人密闭的真空容器中,一定条件下,发生反应:4KO2(s)?2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡.下列说法正确的是( )| A. | 容器内压强增大 | B. | KO2的量保持不变 | C. | 平衡常数减小 | D. | 氧气浓度不变 |
分析 对于反应4KO2(s)?2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,相当于增大压强,平衡逆向移动,化学平衡常数只与温度有关,据此分析解答.
解答 解:A.缩小容器体积,相当于增大压强,平衡向逆反应方向移动,化学平衡常数=c(O2)3,温度不变,化学平衡常数不变,则氧气浓度不变,所以压强不变,故A错误;
B.平衡向逆反应方向移动,则KO2量增加,故B错误;
C.化学平衡常数只与温度有关,温度不变,平衡常数不变,故C错误;
D.化学平衡常数=c(O2)3,温度不变,化学平衡常数不变,则氧气浓度不变,故D正确;
故选D.
点评 本题考查了可逆反应平衡移动,根据压强与平衡移动方向之间的关系分析解答即可,注意平衡常数只与温度有关,与物质浓度无关,为易错点.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
12.下列说法正确的是( )
| A. | 在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
13.关于溴乙烷与NaOH的乙醇溶液反应的现象和产物检验,说法正确的是( )
| A. | 往反应后的溶液中加入AgNO3溶液检验是否有Br-生成 | |
| B. | 实验中观察不到有气体生成 | |
| C. | 生成的气体可直接通入到溴水中检验是否有乙烯生成 | |
| D. | 生成的气体可直接通入到酸性高锰酸钾溶液中检验是否有乙烯生成 |
10.工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
CrO${\;}_{4}^{2-}$(黄色)$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$(橙色)$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)•c3(OH-)=10-32
下列有关说法不正确的是( )
CrO${\;}_{4}^{2-}$(黄色)$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$(橙色)$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)•c3(OH-)=10-32
下列有关说法不正确的是( )
| A. | 步骤①中当v正(CrO42-)=2v逆(Cr2O72-)时,说明反应:2CrO42-+2H+?Cr2O72-+H2O 达到平衡状态 | |
| B. | 若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色 | |
| C. | 步骤②中,若要还原1 mol Cr2O72-离子,需要12 mol (NH4)2Fe(SO4)2 | |
| D. | 步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全) |
17.下列说法不正确的是( )
| A. | ${\;}_{55}^{133}Cs$和${\;}_{55}^{137}Cs$互为同位素 | |
| B. | ${\;}_{67}^{166}Ho$的原子核内的中子数与核外电子数之差为32 | |
| C. | 元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 | |
| D. | 1 mol KHSO4加热熔化可电离出2NA个阳离子 |
14.下列物质中含有碳碳双键的是( )
| A. | 乙烷 | B. | 乙炔 | C. | 乙烯 | D. | 苯 |
11.下列各组物质熔化或升华时,所克服的粒子间作用力属于同种类型的是( )
| A. | Na20和SiO2熔化 | B. | 冰和金刚石熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | 碘和干冰升华 |
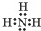 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.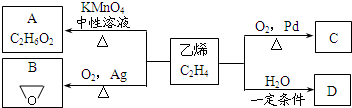 乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.
乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.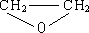 +H2O$\stackrel{一定条件}{→}$
+H2O$\stackrel{一定条件}{→}$ .
.