题目内容
7.短周期元素N、Na、Al形成的物质在工农业生产、生活中应用广泛.(1)Al在元素周期表中的位置为第三周期IIIA族;其原子半径比Na小(填“大”或“小”).
(2)Al单质在空气中不易腐蚀,原因是其表面形成了一种致密的且熔点高的化合物.该化合物的晶体类型为离子晶体;该化合物遇酸碱易被腐蚀,请写出它与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)NH3的电子式为
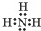 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.(4)标准状况下22.4L NH3与0.5L1mol/L 氮元素的最高价氧化物的水化物反应,所得溶液中离子浓度由大到小的顺序是c(NH4+)>c(NO3-)>c(OH-)>c(H+).
(5)NF3是一种新型电子材料,常温下为稳定气体,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和某种物质.请写出反应的化学方程式3NF3+5H2O=9HF+2NO+HNO3.
分析 (1)Al的原子序数为13,含有两个电子层、最外层含有3个电子,据此判断在周期表中的位置;同一周期中原子序数越大、原子半径越小;
(2)该氧化物为氧化铝,氧化铝晶体为离子晶体;氧化铝为两性氧化物,能够与氢氧化钠反应生成偏铝酸钠和水;
(3)氨气为共价化合物,其分子中含有3个氮氢键,据此写出其电子式;氨气分子中存在氢键,导致其沸点较高;
(4)标况下22.4L氨气的物质的量为1mol,氮元素的最高价氧化物的水化物为硝酸,0.5L 1mol/L的硝酸溶液中含有硝酸的物质的量为:1mol/L×0.5L=0.5mol;1mol氨气与0.5mol硝酸反应,反应后得到等物质的量的NH3•H2O和NH4NO3的混合溶液,溶液显碱性,结合电荷守恒判断离子浓度大小顺序;
(5)根据化合价变化判断,F元素化合价不变,N元素变成NO化合价降低,则另一种物质中的元素化合价只能升高,结合元素组成可知另一种物质为硝酸,据此写出反应的化学方程式.
解答 解:(1)铝的核电荷数为13,位于周期表中第三周期IIIA族;铝的原子序数大于Na,二者处于同一周期,则Al的原子半径小于钠,
故答案为:第三周期IIIA族;小;
(2)Al单质在空气中不易腐蚀,原因是其表面形成了一种致密的且熔点高的化合物氧化铝,氧化铝属于离子晶体;氧化铝具有两性,能够与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:离子晶体;Al2O3+2OH-=2AlO2-+H2O;
(3)氨气属于共价化合物,其电子式为: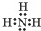 ;氨气中N的电负性较强,容易形成氢键,大大增强了分子间作用力,所以其沸点较高,
;氨气中N的电负性较强,容易形成氢键,大大增强了分子间作用力,所以其沸点较高,
故答案为: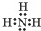 ; NH3分子间有氢键;
; NH3分子间有氢键;
(4)标况下22.4L氨气的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,
氮元素的最高价氧化物的水化物为硝酸,0.5L 1mol/L的硝酸溶液中含有硝酸的物质的量为:1mol/L×0.5L=0.5mol
1mol氨气与0.5mol硝酸反应生成0.5mol硝酸铵,还剩余0.5mol一水合氨,
即:反应后得到等物质的量的NH3•H2O和NH4NO3的混合溶液,一水合氨的电离程度大于铵根离子的水解程度,则溶液显碱性:c(OH-)>c(H+),结合电荷守恒可得:c(NH4+)>c(NO3-),所以溶液中离子浓度大小顺序为:c(NH4+)>c(NO3-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(NO3-)>c(OH-)>c(H+);
(5)NF3是一种新型电子材料,常温下为稳定气体,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和某种物质,NF3→NO,化合价降低1价,而F元素化合价不变,NF3中N元素的化合价为+3价,根据质量守恒定律可知另一种物质中含有化合价大于+3的N元素,还应该含有H元素,故另一种物质为硝酸,反应的化学方程式为:3NF3+5H2O=9HF+2NO+HNO3,
故答案为:3NF3+5H2O=9HF+2NO+HNO3.
点评 本题考查较综合,涉及离子浓度大小比较、物质的量浓度的计算、常见化学用语的书写等知识,题目难度中等,注意掌握原子结构与元素周期律的关系,明确离子浓度大小比较的方法.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | 等质量的硫蒸汽和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 由C(金刚石)═C(石墨)△H=-1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | NH3的稳定性强,是因为其分子之间存在氢键 |
| A. | 3种 | B. | 5种 | C. | 8种 | D. | 9种 |
| A. | 乙烯与溴水(加成反应) | |
| B. | 苯与浓硝酸(取代反应) | |
| C. | 乙醇与乙酸(酯化反应) | |
| D. | 乙醇与氧气在铜作催化剂下反应(取代反应) |
| A. | 容器内压强增大 | B. | KO2的量保持不变 | C. | 平衡常数减小 | D. | 氧气浓度不变 |
| A. | CO2和H2O | B. | NaCl和HCl | C. | SO2和SiO2 | D. | NaOH和CCl4 |
| A. | 适宜条件下,SO2和O2可以完全转化为SO3 | |
| B. | 反应达到平衡后正逆反应的速率皆为零 | |
| C. | 若用18O2进行反应,达到平衡时二氧化硫中也会有18O | |
| D. | 工业合成SO3时,既要考虑反应速率也要考虑反应限度 |
| A. | 标准状况下22.4LH20中共价键总数为2NA | |
| B. | 32gO3中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入1molN2和3 mol H2,充分反应后得2NA个NH3分子 | |
| D. | 1.8g的NH4+中含有电子的物质的量为1mol |


 ,它的分子中含有4种不同化学环境的氢原子.
,它的分子中含有4种不同化学环境的氢原子. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.