题目内容
17.下列说法不正确的是( )| A. | ${\;}_{55}^{133}Cs$和${\;}_{55}^{137}Cs$互为同位素 | |
| B. | ${\;}_{67}^{166}Ho$的原子核内的中子数与核外电子数之差为32 | |
| C. | 元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 | |
| D. | 1 mol KHSO4加热熔化可电离出2NA个阳离子 |
分析 A、质子数相同中子数不同的同种元素的不同原子互称同位素;
B、质量数=质子数+中子数计算分析;
C、L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等;
D、1 mol KHSO4加热熔化可电离出NA个阳离子.
解答 解:A、${\;}_{55}^{133}Cs$和${\;}_{55}^{137}Cs$质子数相同,中子数不同,互为同位素,故A正确;
B、原子核内的中子数与核外电子数之差=166-67-67=32,故B正确;
C、L层电子为奇数,1、3、5、7,则元素所在族序数也分别是ⅠA、ⅢA、ⅤA、ⅤⅡA,故C正确;
D、1 mol KHSO4加热熔化可电离出NA个阳离子,故D错误.
故选D.
点评 本题考查了原子结构,物质性质和组成的分析,元素周期表中的有关元素知识的考查,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
7.和醛基相邻的碳原子上的氢叫α氢.没有α氢的醛在浓的强碱作用下发生分子间氧化还原反应生成羧酸和醇,叫做康尼查罗反应.例如:2HCHO+NaOH→CH3OH+HCOONa.下列化合物中,不能发生康尼查罗反应的是( )
| A. | 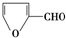 | B. |  | C. | (CH3)3CCHO | D. | CH3CHO |
8.关于下图所示转化关系(X代表卤素),说法不正确的是( )


| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | 生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | F、Cl、Br的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 | |
| D. | F2、Cl2分别发生反应I,同一温度下的平衡常数分别为K1、K2,则K1>K2 |
2.将KO2放人密闭的真空容器中,一定条件下,发生反应:4KO2(s)?2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡.下列说法正确的是( )
| A. | 容器内压强增大 | B. | KO2的量保持不变 | C. | 平衡常数减小 | D. | 氧气浓度不变 |
9.新华网报道${\;}_{43}^{99}$Tc可作医学放射性用途.下列关于${\;}_{43}^{99}$Tc的叙述正确的是( )
| A. | 原子序数是99 | B. | 质量数是43 | C. | 中子数是99 | D. | 电子数是43 |
6.下列分离方法中,正确的是( )
①用蒸馏法分离乙醇和水的混合物 ②用色谱法分离菠菜叶中的色素 ③用升华法分离碘和砂子的混合物 ④用重结晶法提纯苯甲酸 ⑤用分液法分离苯和溴苯的混合物.
①用蒸馏法分离乙醇和水的混合物 ②用色谱法分离菠菜叶中的色素 ③用升华法分离碘和砂子的混合物 ④用重结晶法提纯苯甲酸 ⑤用分液法分离苯和溴苯的混合物.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ②③④⑤ |
 ,试剂b中官能团的名称是氯原子、碳碳双键.③的反应类型是氧化反应.
,试剂b中官能团的名称是氯原子、碳碳双键.③的反应类型是氧化反应. ;由F生成一硝化产物的化学方程式为
;由F生成一硝化产物的化学方程式为 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O.
+H2O.