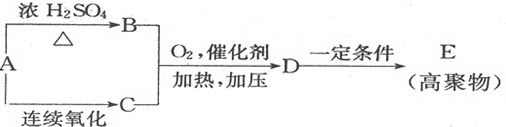
题目内容
6.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质, 该单质常温下化学性质很稳定. |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
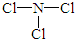
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
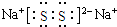 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
分析 I.X、Y、Z、R四种元素均为短周期元素,含Y元素的物质焰色反应为黄色,则Y为Na;X单质为双原子分子,若低温蒸发液态空气,因其沸点较低可先获得X的单质,则X为N元素;Z同周期元素中原子半径最小,Y、Z、R同周期,则Z为Cl,R元素原子的最外层电子数是K层电子数的3倍,则R为S元素,据此解答;
II.X为N元素,元素X与氢可形成多种化合物,如丙、丁、戊,丙与醋酸类似,为一元弱酸,设丙的分子式为HNm,HNm分解的方程式为2HNm=H2+mN2,8.6gHNm爆炸分解生成H2和6.72L(标况下)N2,则有$\frac{\frac{2}{8.6}}{1+14m}$=$\frac{m}{0.3}$,解得m=3,所以丙为HN3,丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则戊的相对分子质量为0.76×22.4=17,所以戊为氨气,则丁为NH4H,据此解答.
解答 解:I.X、Y、Z、R四种元素均为短周期元素,含Y元素的物质焰色反应为黄色,则Y为Na;X单质为双原子分子,若低温蒸发液态空气,因其沸点较低可先获得X的单质,则X为N元素;Z同周期元素中原子半径最小,Y、Z、R同周期,则Z为Cl,R元素原子的最外层电子数是K层电子数的3倍,则R为S元素,
(1)Z为Cl,Z元素在周期表的位置是第三周期第ⅦA族,电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小,所以Y、Z、R简单离子的半径从大到小的顺序是 S2->Cl->Na+,
故答案为:第三周期第ⅦA族; S2->Cl->Na+;
(2)由N、Cl两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里N、Cl两种原子最外层均达到8个电子的稳定结构,则N、Cl个数比应为1:3,甲遇水蒸气可形成一种常见的漂白性物质应为次氯酸,所以在甲中氯显+1价,所以甲的结构式为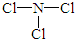 ,
,
故答案为: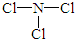 ;
;
(3)化合物乙为Na2S溶液在空气中长期放置,与氧气反应会生成Na2S2,则Na2S2的电子式为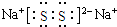 ,Na2S溶液在空气中变质过程的化学方程式为4Na2S+O2+2H2O═4NaOH+2Na2S2,
,Na2S溶液在空气中变质过程的化学方程式为4Na2S+O2+2H2O═4NaOH+2Na2S2,
故答案为: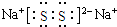 ;4Na2S+O2+2H2O═4NaOH+2Na2S2;
;4Na2S+O2+2H2O═4NaOH+2Na2S2;
Ⅱ.X为N元素,元素X与氢可形成多种化合物,如丙、丁、戊,
(4)丙与醋酸类似,为一元弱酸,设丙的分子式为HNm,HNm分解的方程式为2HNm=H2+mN2,8.6gHNm爆炸分解生成H2和6.72L(标况下)N2,则有$\frac{\frac{2}{8.6}}{1+14m}$=$\frac{m}{0.3}$,解得m=3,所以丙为HN3,HN3爆炸的化学方程式为2HN3=3N2+H2,
故答案为:2HN3=3N2+H2;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则戊的相对分子质量为0.76×22.4=17,所以戊为氨气,则丁为NH4H,
故答案为:NH4H.
点评 本题考查结构性质位置关系应用,难度不大,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律.

| A. | 所有物质中均存在化学键 | |
| B. | 非金属元素间形成的化合物一定是共价化合物 | |
| C. | 离子化合物中可能含非极性共价键 | |
| D. | 有共价键的化合物一定是共价化合物 |
| A. | pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
| A. | CO2 | B. | H2SO4溶液 | C. | BaSO4 | D. | NaOH溶液 |

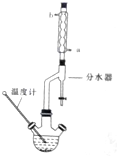 实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50mL三颈烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加3~4滴浓硫酸,摇匀,然后安装分水器投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水),温度计及回流冷凝管,加热冷凝回流反应.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL水洗涤,有机层继续用10mL 10% Na2CO3溶液洗涤至中性,再用10mL水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯注入50mL烧瓶中,常压蒸馏,收集125~127°C的馏分,得11.6g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)管口通入;
(2)写出该制备反应的化学方程式:CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O;
(3)步骤①中不断从分水器下部分出生成的水的目的是使平衡正向移动,提高反应产率;
(4)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2C03溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质;
(5)下列关于分液漏斗的使用叙述正确的是D(填字母);
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(6)该实验过程中,生成乙酸正丁酯(相对分子质量为116)的产率是80%.
| A. | CH3OH | B. | CH2OHCH2CH3 | C. | (CH3)2COHCH3 | D. | (CH3)3COH |
| d | ||
| a | b | c |
| A. | c的简单离子的电子层数等于其所在周期的周期序数 | |
| B. | d的氢化物的稳定性比b的氢化物强 | |
| C. | 原子半径的大小顺序是:c>b>a>d | |
| D. | 在a、b、c的最高价氧化物对应水化物中,酸性最强的是c的最高价氧化物对应水化物 |