题目内容
4.下列说法正确的是( )| A. | 所有物质中均存在化学键 | |
| B. | 非金属元素间形成的化合物一定是共价化合物 | |
| C. | 离子化合物中可能含非极性共价键 | |
| D. | 有共价键的化合物一定是共价化合物 |
分析 A.稀有气体中不存在化学键;
B.铵盐全部由非金属元素组成,为离子化合物;
C.离子化合物中一定含有离子键,可能含有非极性共价键;
D.只含有共价键的化合物属于共价化合物.
解答 解:A.稀有气体为单原子构成的分子,不存在化学键,故A错误;
B.因铵盐全部由非金属元素组成,为离子化合物,则全部由非金属元素形成的化合物不一定是共价化合物,故B错误;
C.离子化合物中一定含有离子键,可能含有非极性共价键,如Na2O2中含有O-O非极性键,故C正确;
D.只含有共价键的化合物属于共价化合物,含有共价键的化合物也可能含有离子键,如NaOH中含有共价键和离子键,属于离子化合物,故D错误.
故选C.
点评 本题考查化学键及化合物的类别,熟悉一般金属元素与非金属元素形成离子键,非金属元素之间形成共价键及特殊物质中的化学键即可解答,注意利用实例来分析解答.

练习册系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | Na投入足量盐酸中:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 向Na2CO3溶液中加入少量盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | NaHCO3溶液中加入过量澄清石灰水:Ca2++HCO3-+OH-=H2O+CaCO3↓ |
12.下列对于过氧化钠的叙述中,正确的是( )
| A. | 78g过氧化钠中含阴离子2mol | |
| B. | 过氧化钠能与水反应,所以过氧化钠可以作很多气体的干燥剂 | |
| C. | 过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂 | |
| D. | 过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
19.某同学按如图所示的装置进行试验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交换膜处SO42-从右向左移动.下列分析错误的是( )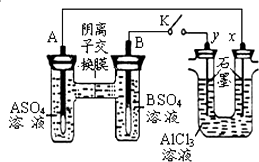

| A. | 金属活动性A强于B | |
| B. | 反应初期,y电极的电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 反应初期,x电极周围出现白色沉淀,后来电极附近沉淀溶解 | |
| D. | 电解一段时间后将AlCl3溶液倒入烧杯并搅拌可得到偏铝酸盐溶液 |
16. 科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
 科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )| A. | 反应①属于取代反应 | B. | W中至少含有1个手性碳原子 | ||
| C. | X、Y、W、Z都能与NaOH溶液反应 | D. | 可用溴水或FeCl3溶液鉴别X和W |
13.煤、石油、天然气是重要的能源和化工原料,下列说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油产品都可用于聚合反应 | |
| C. | 水煤气是通过煤的液化得到的气态燃料 | |
| D. | 天然气是清洁燃料 |
6.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
(1)Z元素在周期表的位置是第三周期第ⅦA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示)
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质, 该单质常温下化学性质很稳定. |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为

(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
 发生酯化反应的产物A是一种食用香料;11.6g甲完全燃烧可产生0.6mo1CO2和0.6mo 1H2O.相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基.
发生酯化反应的产物A是一种食用香料;11.6g甲完全燃烧可产生0.6mo1CO2和0.6mo 1H2O.相同条件下,甲蒸气对氧气的相对密度为1.8125,甲分子为链状结构且不含甲基. 生成A的化学方程式为
生成A的化学方程式为  $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ .
.