题目内容
16.如表是周期表中短周期的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )| d | ||
| a | b | c |
| A. | c的简单离子的电子层数等于其所在周期的周期序数 | |
| B. | d的氢化物的稳定性比b的氢化物强 | |
| C. | 原子半径的大小顺序是:c>b>a>d | |
| D. | 在a、b、c的最高价氧化物对应水化物中,酸性最强的是c的最高价氧化物对应水化物 |
分析 a原子最外层的电子数比次外层少3,说明A只能为15号元素磷,则b、c、d依次为硫、氯、氧,根据元素周期律的递变规律和对应单质、化合物的性质分析.
A、c为Cl元素,其简单离子为Cl-;
B、非金属性越强,氢化物的稳定性越强;
C、电子层数越多,原子半径越大;当电子层数相同时,核电荷数越大,半径越小;
D、非金属性越强,最高价含氧酸的酸性越强.
解答 解:A、c为Cl元素,其简单离子为Cl-,有3个电子层,与氯元素的额周期序数相同,故A正确;
B、非金属性越强,氢化物的稳定性越强,而同一主族从上到下,非金属性逐渐减弱,即d的非金属性强于b,故d的氢化物的稳定性比b的氢化物强,故B正确;
C、当比较原子半径大小时,首先考虑电子层数,电子层数越多,原子半径越大,故d的原子半径最小;当电子层数相同时,核电荷数越大,半径越小,故a、b、c的原子半径逐渐减小,故大小顺序为:a>b>c>d,故C错误;
D、非金属性越强,最高价含氧酸的酸性越强,而同一周期从左到右,元素的非金属性逐渐增强,即酸性最强的是c的最高价氧化物对应水化物,故D正确.
故选C.
点评 本题考查元素周期表与元素周期律,比较基础,侧重对元素周期律的考查,注意整体把握元素周期表的结构.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
6.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
(1)Z元素在周期表的位置是第三周期第ⅦA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示)
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质, 该单质常温下化学性质很稳定. |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为

(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
7.下列叙述不正确的是( )
| A. | 大自然利用太阳能最成功的是植物的光合作用 | |
| B. | H2是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用 | |
| C. | 海水淡化技术的进步有助于淡水资源紧缺问题的解决 | |
| D. | 利用工业废气中的CO2制造全降解塑料,符合绿色环保要求 |
4.一定温度下,一密闭且体积不变的容器内有可逆反应:A(g)+2B(g)?2C(g).该反应进行到一定限度后达到了化学平衡,不能做为判断该化学平衡标志的是( )
| A. | 容器内气体A的物质的量不再随时间而改变 | |
| B. | 容器内气体C的浓度不再随时间而改变 | |
| C. | 单位时间内生成amol物质A,同时生成2amol物质B | |
| D. | 单位时间内生成amol物质A,同时生成2amol物质C |
1.丁香油酚的结构简式为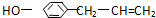 从它的结构简式可推测它不可能有的化学性质是( )
从它的结构简式可推测它不可能有的化学性质是( )
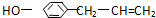 从它的结构简式可推测它不可能有的化学性质是( )
从它的结构简式可推测它不可能有的化学性质是( )| A. | 既可燃烧,也可使酸性KMnO4溶液褪色 | |
| B. | 可与NaHCO3溶液反应放出CO2气体 | |
| C. | 可与FeCl3溶液发生显色反应 | |
| D. | 既可与Br2发生加成反应又可发生取代反应 |
5.下列实验方法不正确的是( )
| A. | 用重结晶法可除去KNO3晶体中混有少量NaCl晶体 | |
| B. | 实验室制取乙酸丁酯时用水浴加热 | |
| C. | 在硫酸钡悬浊液中加入足量饱和碳酸钠溶液可将其转化为碳酸钡 | |
| D. | 二氧化硫分别通入到硫化钠和硝酸钡溶液中产生沉淀可证明二氧化硫的氧化性和还原性 |



