题目内容
1.
 实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50mL三颈烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加3~4滴浓硫酸,摇匀,然后安装分水器投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水),温度计及回流冷凝管,加热冷凝回流反应.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL水洗涤,有机层继续用10mL 10% Na2CO3溶液洗涤至中性,再用10mL水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯注入50mL烧瓶中,常压蒸馏,收集125~127°C的馏分,得11.6g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)管口通入;
(2)写出该制备反应的化学方程式:CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O;
(3)步骤①中不断从分水器下部分出生成的水的目的是使平衡正向移动,提高反应产率;
(4)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2C03溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质;
(5)下列关于分液漏斗的使用叙述正确的是D(填字母);
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(6)该实验过程中,生成乙酸正丁酯(相对分子质量为116)的产率是80%.
分析 (1)冷凝管中冷凝水应从下口进上口出;
(2)乙酸与正丁醇在浓硫酸作催化剂、加热条件下发生酯化反应生成CH3COOCH2CH2CH2CH3与水;
(3)分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;
(4)乙酸与水互溶,正丁醇溶于水,先用水洗涤,可以除去乙酸及少量的正丁醇;用饱和Na2CO3溶液洗涤有机层,除去产品中含有的乙酸等杂质;
(5)A.旋塞与玻璃塞处均检验是否漏水;
B.分液漏斗中液体的总体积不宜超过其容积的一半;
C.振荡时应倒置分液漏斗;
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,平衡分液漏斗内气压,便于液体流向;
(6)先根据反应方程式计算酸和醇哪个过量,按照量少的计算理论上酯的量,实际上酯的量与理论值之比即为酯的产率.
解答 解:(1)采取逆流原理,冷凝水应充满冷凝管进行充分冷凝,冷凝管中冷凝水应从下口进上口出,
故答案为:a;
(2)该制备反应的化学方程式:CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O,
故答案为:CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O;
(3)反应生成酯与水,属于可逆反应,使用分水器分离出水,使平衡正向移动,提高反应产率,
故答案为:使平衡正向移动,提高反应产率;
(3)乙酸与水互溶,正丁醇溶于水,先用水洗涤,可以除去乙酸及少量的正丁醇;用饱和Na2CO3溶液洗涤有机层,除去产品中含有的乙酸等杂质,
故答案为:除去乙酸及少量的正丁醇;除去产品中含有的乙酸等杂质;
(4)A.旋塞与玻璃塞处均检验是否漏水,故A错误;
B.分液漏斗中液体的总体积不得超过其容积的一半,若装得太多,不利于液体振荡混合,故B错误;
C.应使分液漏斗口朝下,使分液漏斗长颈朝上,便于振荡混合、便于放气降低分液漏斗内气压,故C错误;
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,平衡分液漏斗内气压,便于液体流出,故D正确,
故答案为:D;
(6)13.5mL正丁醇的质量为13.5mL×0.80g/mL=10.8g,7.2mL冰醋酸的质量为7.2mL×1.045g/mL=7.524g,
设理论上10.8g正丁醇完全反应需乙酸的质量是y,则:
CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
60g 74g
y 10.8g
y=$\frac{10.8g×60g}{74g}$=8.76g>7.524,所以乙酸不足,按照乙酸的量计算乙酸正丁醇酯的理论质量,
设乙酸正丁醇酯的理论质量为x,则:
CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
60g 116g
7.524g x
所以x=$\frac{7.524g×116g}{60g}$≈14.5g
则乙酸正丁酯的产率为$\frac{11.6g}{14.5g}$×100%≈80%,
故答案为:80%.
点评 本题考查有机物物质制备的实验,涉及对反应原理的理解应用、对操作的分析评价、物质的分离提纯、产率计算等,注意根据乙酸乙酯的制备进行知识迁移应用,较好的考查学生的分析能力、数据处理能力,难度中等.

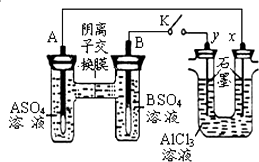
| A. | 金属活动性A强于B | |
| B. | 反应初期,y电极的电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 反应初期,x电极周围出现白色沉淀,后来电极附近沉淀溶解 | |
| D. | 电解一段时间后将AlCl3溶液倒入烧杯并搅拌可得到偏铝酸盐溶液 |
| A. | 乙烯的结构简式为CH2CH2 | B. | 6个中子的碳原子的符号:12C | ||
| C. | Cl-的结构示意图: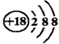 | D. | NaCl的电子式: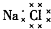 |
| A. | 氨气遇到HCl时,可以迅速反应生成NH4Cl | |
| B. | 0.5molNH4Cl中含有氢原子的质量是2克 | |
| C. | NH4Cl易溶于水,很稳定,受热不会分解 | |
| D. | 加热NH4Cl和碱的混合物,可以制取到氨气 |
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质, 该单质常温下化学性质很稳定. |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为

(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
| A. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| B. | 乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液 | |
| C. | 乙烷中混有乙烯,加入氢气在一定条件下充分反应 | |
| D. | 溴苯中混有溴,加入KI溶液后,用分液漏斗分液 |
| A. | 用食醋除去暖水瓶中的水垢 | |
| B. | 用酒精清洗银器表面的氧化膜 | |
| C. | 用米汤检验含碘盐中的碘酸钾(KIO3) | |
| D. | 用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
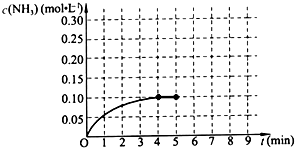 已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: