题目内容
5.常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是( )| A. | pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
分析 A.氢离子和氢氧根离子反应生成水,钠离子不参加反应;
B.任何电解质溶液都存在电荷守恒;
C.常温下,pH<7,说明溶液呈酸性;
D.常温下,pH=7,说明溶液呈中性,根据电荷守恒来回答.
解答 解:A、氢离子和氢氧根离子反应生成水,钠离子不反应,所以c(Na+)>c(OH-),故A选;
B.任何电解质溶液都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故B不选;
C.常温下,pH<7,说明溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒:c(CH3COO-)>c(Na+),c(CH3COO-)>c(H+)>c(Na+)>c(OH-)可以是剩余大量醋酸时候的情况,故C不选;
D.常温下,pH=7,说明溶液呈中性,则c(OH-)=c(H+),根据电荷守恒:c(CH3COO-)=c(Na+),故D选.
故选AD.
点评 本题考查了物质的推断、离子浓度大小的比较,明确溶液中存在的溶质及其性质是解本题关键,并结合溶液的酸碱性、电荷守恒来分析解答,难度中等.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | Na投入足量盐酸中:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 向Na2CO3溶液中加入少量盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | NaHCO3溶液中加入过量澄清石灰水:Ca2++HCO3-+OH-=H2O+CaCO3↓ |
16. 科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
 科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )| A. | 反应①属于取代反应 | B. | W中至少含有1个手性碳原子 | ||
| C. | X、Y、W、Z都能与NaOH溶液反应 | D. | 可用溴水或FeCl3溶液鉴别X和W |
13.煤、石油、天然气是重要的能源和化工原料,下列说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油产品都可用于聚合反应 | |
| C. | 水煤气是通过煤的液化得到的气态燃料 | |
| D. | 天然气是清洁燃料 |
20.正确掌握化学用语是学好化学的基础.下列化学用语中正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | 6个中子的碳原子的符号:12C | ||
| C. | Cl-的结构示意图: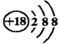 | D. | NaCl的电子式: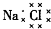 |
10.下列实验操作正确的是( )
| A. | 给烧杯里的液体直接加热 | |
| B. | 将配制的NaOH溶液保存在配有玻璃塞的细口瓶中 | |
| C. | 用蒸发方法使KCl 从溶液中析出时,应将蒸发皿中KCl 溶液全部加热蒸干 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
6.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
(1)Z元素在周期表的位置是第三周期第ⅦA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示)
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为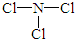
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为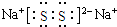 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质, 该单质常温下化学性质很稳定. |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
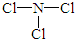
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
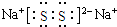 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
7.下列叙述不正确的是( )
| A. | 大自然利用太阳能最成功的是植物的光合作用 | |
| B. | H2是理想的清洁燃料,储存和运输方便,在现实生活和生产中已大量应用 | |
| C. | 海水淡化技术的进步有助于淡水资源紧缺问题的解决 | |
| D. | 利用工业废气中的CO2制造全降解塑料,符合绿色环保要求 |
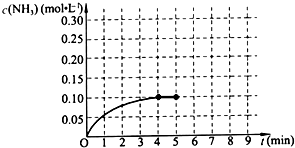 已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: