题目内容
2.下列物质属于电解质的是( )| A. | CO2 | B. | H2SO4溶液 | C. | BaSO4 | D. | NaOH溶液 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,电解质必须首先是化合物,混合物不是电解质.
解答 解:A、二氧化碳不能电离,属于非电解质,故A错误;
B、硫酸溶液为混合物,既不是电解质也不是非电解质,故B错误;
C、硫酸钡为盐,熔融状态下可以导电,属于电解质,故C正确;
D、氢氧化钠溶液为混合物,既不是电解质也不是非电解质,故D错误,故选C.
点评 本题考查了电解质的判断,难度不大,易错选项是B和D,注意:硫酸溶液和氢氧化钠溶液是混合物不是化合物

练习册系列答案
相关题目
12.下列对于过氧化钠的叙述中,正确的是( )
| A. | 78g过氧化钠中含阴离子2mol | |
| B. | 过氧化钠能与水反应,所以过氧化钠可以作很多气体的干燥剂 | |
| C. | 过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂 | |
| D. | 过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
13.煤、石油、天然气是重要的能源和化工原料,下列说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油产品都可用于聚合反应 | |
| C. | 水煤气是通过煤的液化得到的气态燃料 | |
| D. | 天然气是清洁燃料 |
10.下列实验操作正确的是( )
| A. | 给烧杯里的液体直接加热 | |
| B. | 将配制的NaOH溶液保存在配有玻璃塞的细口瓶中 | |
| C. | 用蒸发方法使KCl 从溶液中析出时,应将蒸发皿中KCl 溶液全部加热蒸干 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
6.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
(1)Z元素在周期表的位置是第三周期第ⅦA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示)
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质, 该单质常温下化学性质很稳定. |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为

(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2II.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,对热稳定但受撞击就爆炸.8.6g丙爆炸分解生成0.1molH2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H.
4.一定温度下,一密闭且体积不变的容器内有可逆反应:A(g)+2B(g)?2C(g).该反应进行到一定限度后达到了化学平衡,不能做为判断该化学平衡标志的是( )
| A. | 容器内气体A的物质的量不再随时间而改变 | |
| B. | 容器内气体C的浓度不再随时间而改变 | |
| C. | 单位时间内生成amol物质A,同时生成2amol物质B | |
| D. | 单位时间内生成amol物质A,同时生成2amol物质C |
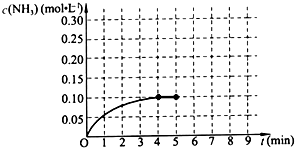 已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: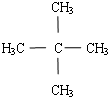 .
.