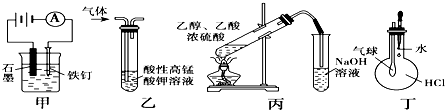
题目内容
20.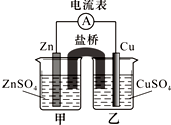 某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.(1)Cu极为原电池的正极(填“正”或“负”),电极反应式是Cu2++2e-═Cu;Zn极发生氧化(填“氧化”或“还原”)反应.
(2)盐桥中K+移向乙(填“甲”或“乙”)烧杯的溶液.取出盐桥,电流计指针不偏转(填“偏转”或“不偏转”).
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,则两烧杯中的电极反应式分别为:甲2Fe3++2e-═2Fe2+(或Fe3++e-═Fe2+),乙Cu-2e-═Cu2+.
分析 锌比铜活泼,形成原电池反应时锌为负极,被氧化,铜为正极,正极发生还原反应,原电池工作时阳离子向正极移动,若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,铜被铁离子氧化,则铜为负极,石墨为正极,正极铁离子得到电子被还原生成亚铁离子,以此解答该题.
解答 解:(1)在甲图装置中,当电流计指针发生偏转时,形成原电池,锌为活泼金属,被氧化而失去电子,铜为原电池正极,正极上得电子而被还原,电极发生为Cu2++2e-═Cu,故答案为:正;Cu2++2e-═Cu;氧化;
(2)原电池中,电解质溶液中,阳离子向正极移动,阴离子向负极移动,即盐桥中K+移向乙烧杯的溶液,取出盐桥,不能形成闭合回路,则电流计指针不偏转,
故答案为:乙; 不偏转;
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,铜被铁离子氧化,则铜为负极,电极方程式为Cu-2e-═Cu2+,石墨为正极,正极铁离子得到电子被还原生成亚铁离子,电极方程式为2Fe3++2e-═2Fe2+(或Fe3++e-═Fe2+),
故答案为:2Fe3++2e-═2Fe2+(或Fe3++e-═Fe2+);Cu-2e-═Cu2+.
点评 本题考查原电池和电解池的工作原理,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握基础知识的积累,掌握电极反应式的书写.

练习册系列答案
相关题目
10.下列化学用语表示正确的是( )
| A. | HClO的电子式为: | |
| B. | 硝基苯的结构简式为: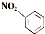 | |
| C. | 含18个中子的氯原子的核素符号:${\;}_{35}^{17}$Cl | |
| D. | 四氯化碳分子比例模型: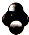 |
11.下列关于化学键和晶体的说法正确的是( )
| A. | 离子晶体中只有离子键 | |
| B. | 非金属元素只能形成共价键 | |
| C. | 水分子中存在氢键,所以水的沸点较高 | |
| D. | 原子晶体的熔点不一定比金属晶体的熔点高 |
8.化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.下图所示的是用燃烧法确定有机物分子式的常用装置.

实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C管中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:D→C→E→B→A(每种装置只用一次);
(2)实验数据记录和处理
上表中①、②分别指哪个装置?B、A
(3)若实验准确称取4.4g样品,经燃烧后测得产生CO28.8g,水蒸气3.6g.要确定该有机物的分子式,还必须知道的数据是样品的摩尔质量;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式CH3CHO,与该有机物相对分子质量相同的烃的一氯代物有2种.

实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C管中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:D→C→E→B→A(每种装置只用一次);
(2)实验数据记录和处理
| 物理量 实验序号 | 燃烧有机物的质量 | ① | ② | ||
| 实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
| 1 | m1 | m2 | m3 | m4 | m5 |
(3)若实验准确称取4.4g样品,经燃烧后测得产生CO28.8g,水蒸气3.6g.要确定该有机物的分子式,还必须知道的数据是样品的摩尔质量;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式CH3CHO,与该有机物相对分子质量相同的烃的一氯代物有2种.
15.二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚.下列叙述正确的是( )
| A. | 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式为:CH3OCH3-12e-+12OH-═2CO2+8H2O | |
| B. | 二甲醚为不可再生能源 | |
| C. | 二甲醚分子中只含有极性键 | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-1455kJ/mol |
5.可逆反应:CO(气)+NO2(气)═CO2(气)+NO(气);△H=-226kJ/mol,在下列情况下不能使反应率加快的是( )
| A. | 充入NO2 | B. | 升高温度 | ||
| C. | 减小压强,扩大容器体积 | D. | 增加压强,缩小容器体积 |
9.下列离子方程式书写错误的是( )
| A. | H2O2和酸性氯化亚铁溶液反应:2Fe2++H2O2+2 H+═2Fe3++2H2O | |
| B. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O | |
| C. | 3 mol的Cl2通入含2 mol FeI2的溶液中:2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2 | |
| D. | 将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O═CaSO3+2HClO |
10.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol硫酸铝钾中阴离子所带电荷总数为2NA | |
| B. | 等质量的乙炔和苯分别完全燃烧,乙炔和苯都消耗7.5NA个氧气分子 | |
| C. | 将0.1mol碳酸钠溶于1L水中,所得溶液含有CO32-和HCO3-共0.1NA个 | |
| D. | 在H2O2作燃料电池的负极原料时,每摩尔H2O2转移的电子数为2 NA |