题目内容
8.化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.下图所示的是用燃烧法确定有机物分子式的常用装置.
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C管中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:D→C→E→B→A(每种装置只用一次);
(2)实验数据记录和处理
| 物理量 实验序号 | 燃烧有机物的质量 | ① | ② | ||
| 实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
| 1 | m1 | m2 | m3 | m4 | m5 |
(3)若实验准确称取4.4g样品,经燃烧后测得产生CO28.8g,水蒸气3.6g.要确定该有机物的分子式,还必须知道的数据是样品的摩尔质量;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式CH3CHO,与该有机物相对分子质量相同的烃的一氯代物有2种.
分析 实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式;因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,
(1)根据以上分析连接各实验装置;
(2)碱石灰能够吸收水和二氧化碳,所以应该先用无水氯化钙测定水的质量,然后用碱石灰测定二氧化碳的质量;
(3)题中数据能够计算出该有机物的实验式,要确定有机物的分子式,还要知道样品的摩尔质量;
(4)根据相对密度计算出该有机物的摩尔质量,再根据n=$\frac{m}{M}$计算出4.4g该有机物及生成二氧化碳、水的物质的量,然后根据质量守恒定律确定含有氧原子的物质的量,从而得出该有机物的分子式;根据核磁共振氢谱确定该有机物的结构简式;根据该有机物的相对分子质量确定烃的名称,然后确定该烃的一氯代物种类.
解答 解:实验原理是通过测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式;因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,
(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选置的连接顺序应是:D→C→E→B→A,
故答案为:D→C→E→B→A;
(2)根据分析可知,有机物燃烧生成水的质量用无水氯化钙的质量变化确定,生成二氧化碳的质量用碱石灰的质量变化确定,而碱石灰能够吸收水和二氧化碳,所以应该先用B无水氯化钙测定水的质量,然后用A碱石灰测定二氧化碳的质量,故①、②分别指的装置为B、A,
故答案为:B;A;
(3)根据燃烧规律,可以计算产物二氧化碳以及水的质量,进而计算碳原子和氢原子的数目,根据氧元素守恒,可以计算是否含有氧元素以及氧原子的数目,进而得到有机物的最简式,要确定分子式,需要再知道样品的摩尔质量,
故答案为:样品的摩尔质量;
(4)4.4g该有机物燃烧生成二氧化碳8.8g,二氧化碳的物质的量为:$\frac{8.8g}{44g/mol}$=0.2mol,则m(C)=12g/mol×0.2mol=2.4g,
生成水3.6g,产生水的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,则m(H)=1g/mol×0.2mol×2=0.4g,
由于m(C)+m(H)=2.4g+0.4g=2.8g<4.4g,则该有机物分子中一定含有氧元素,含有氧原子的物质的量为:$\frac{4.4g-2.8g}{16g/mol}$=0.1mol,
相同条件下,若该有机物蒸气对氢气的相对分子质量为22,则其相对分子质量为:2×22=44,4.4g该有机物的物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,
该有机物分子中含有C、H、O原子数为:N(C)=$\frac{0.2mol}{0.1mol}$=2、N(H)=$\frac{0.2mol×2}{0.1mol}$=4、N(O)=$\frac{0.1mol}{0.1mol}$=1,
所以该有机物的分子式为:C2H4O;
该有机物的核磁共振氢谱上有两个峰,即含有两种类型的氢原子,其强度比为3:1,即两种类型的氢原子数目之比是3:1,则该有机物的结构简式为:CH3CHO;
该有机物的相对分子质量为44,根据商余法:$\frac{44}{14}$=3…2,则与该有机物相对分子质量相同的烃为丙烷:C3H8,丙烷分子中含有2种等效氢原子,其一氯代物有2种,
故答案为:CH3CHO;2.
点评 本题考查探究物质组成的实验,题目难度中等,明确实验原理为解答关键,试题侧重考查有机物分子式、结构简式的确定,注意掌握质量守恒定律在确定有机物分子式中的应用方法,试题培养了学生的分析、理解能力及化学实验能力.

| 编号 | 实验内容 | 实验目的 |
| A | 将少量氯水加入NaBr溶液中,并加适量CCl4振荡、静置 | 比较氯与溴单质的氧化性强弱 |
| B | 分别向2去试管中加入3ml,5%的H2O2溶液,一支放入5℃左右的冷水中,另一支放入40℃左右的热水中,观察 | 比较温度对化学反应速率的影响 |
| C | 向溶液中滴加盐酸酸化的氯化钡溶液 | 检验某溶液中是否一定含SO42- |
| D | 将实验室制得的CO2依次通过饱和NaHCO3溶液和浓硫酸 | 除去CO2中的HCl和H2O蒸气 |
| A. | A | B. | B | C. | C | D. | D |
①2H2(g)+O2(g)═2H2O(l);△H1=-571.6kJ•mol-1
②2H2(l)+O2(l)═2H2O(g);△H2=-482.6kJ•mol-1
则H2的燃烧热为( )
| A. | 571.6 kJ•mol-1 | B. | 482.6 kJ•mol-1 | C. | 285.8 kJ•mol-1 | D. | 241.3 kJ•mol-1 |
| A. | 乙烯和乙醇 | B. | 甲醇和乙醛 | C. | 丁烷和乙酸乙酯 | D. | 葡萄糖和乙酸 |
的生物农药;③应用高效洁净的能源;④田间焚烧秸秆;⑤推广使用节能环保材料.( )
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④⑤ |
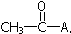 .下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )
.下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )| A. | HCl与之加成,生成CH3COCl | B. | CH3OH与之加成,生成CH3COCH2OH | ||
| C. | H2O与之加成,生成CH3COOH | D. | CH3COOH与之加成,生成 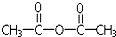 |
| A. | CS2的结构式:S=C=S | |
| B. | HCO-3的水解HCO3-+H2O?H3O++CO32- | |
| C. | 乙酸的结构简式:C2H6O2 | |
| D. | Mg2+的结构示意图: |
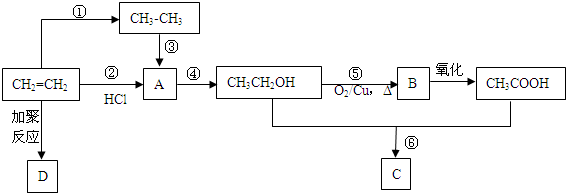
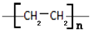 .
. CH3COOC2H5+H2O.
CH3COOC2H5+H2O. 某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.