题目内容
10.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1mol硫酸铝钾中阴离子所带电荷总数为2NA | |
| B. | 等质量的乙炔和苯分别完全燃烧,乙炔和苯都消耗7.5NA个氧气分子 | |
| C. | 将0.1mol碳酸钠溶于1L水中,所得溶液含有CO32-和HCO3-共0.1NA个 | |
| D. | 在H2O2作燃料电池的负极原料时,每摩尔H2O2转移的电子数为2 NA |
分析 A.1mol硫酸铝钾中含有2mol硫酸根离子,阴离子带有电荷为4mol;
B.没有告诉具体质量,无法计算消耗氧气的量;
C.溶液中还存在少量碳酸分子,碳酸根离子和碳酸氢根离子的总物质的量小于0.1mol;
D.双氧水中氧元素的化合价为-1价,1mol双氧水完全反应失去2mol电子.
解答 解:A.1mol硫酸铝钾中含有2mol硫酸根离子,则阴离子所带电荷为4mol,所带电荷总数为4NA,故A错误;
B.缺少苯和乙炔的质量,无法计算消耗氧气的量,故B错误;
C.将0.1mol碳酸钠溶于1L水中,溶液中存在碳酸分子、碳酸根离子和碳酸氢根离子,根据物料守恒,所得溶液含有HCO3-、CO32-和HCO3-共0.1NA个,故C错误;
D.H2O2作燃料电池的负极原料时,每摩尔H2O2转移2mol电子,转移的电子数为2 NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;B为易错点,注意题中缺少具体的质量.

练习册系列答案
相关题目
18.下列各项表达中正确的是( )
| A. | CS2的结构式:S=C=S | |
| B. | HCO-3的水解HCO3-+H2O?H3O++CO32- | |
| C. | 乙酸的结构简式:C2H6O2 | |
| D. | Mg2+的结构示意图: |
5.有关化学用语正确的( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 四氯化碳的电子式: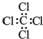 | ||
| C. | 甲烷分子的比例模型: | D. | HClO的结构式:H-Cl-O |
15.根据下列短周期元素性质的数据判断,下列说法正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 元素⑦位于第3周期ⅤA族 | |
| B. | 元素⑤⑥形成的化合物是共价化合物 | |
| C. | 元素①⑧形成的化合物具有两性 | |
| D. | 元素③的最高价氧化物对应水化物碱性最强 |
2. 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
(1)氧化铁与铝反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,该反应为放热反应(填“吸”或“放”);
(2)镁带燃烧的现象是放热,发出耀眼白光,有白烟,镁带的作用是燃烧时提供热量,引发反应;
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
同学们分析数据后推测该熔融物是一种合金,其中的金属是Al、Fe,溶解该合金可选用下列试剂中的BC(填序号).
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:(1)氧化铁与铝反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,该反应为放热反应(填“吸”或“放”);
(2)镁带燃烧的现象是放热,发出耀眼白光,有白烟,镁带的作用是燃烧时提供热量,引发反应;
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
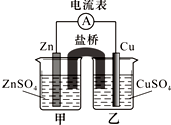 某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液. (1)第一电离能介于B、N之间的第二周期元素有3种.
(1)第一电离能介于B、N之间的第二周期元素有3种.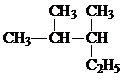 2,3-二甲基戊烷.
2,3-二甲基戊烷. 表示的分子式为C6H14;名称是2-甲基戊烷.
表示的分子式为C6H14;名称是2-甲基戊烷. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.