��Ŀ����
����Ŀ��IA��B��C��D����Ԫ�صĺ˵������С��18��AԪ��ԭ�Ӻ���ֻ��1�����ӣ�B�ǵؿ��к�������Ԫ�أ�B��C���γ����ֻ�����CB��CB2��C���������������۾���ֵ��ȣ�CB�ж���CB2���������D��������Neԭ����ͬ�ĵ��Ӳ�ṹ��

��1�����ж�A��B��C��D����Ԫ�ص����ơ�A______��B_____��C______��D______��
��2��C�����ڱ��е�λ���� ��
��3����B��D����Ԫ����ɵ�D2B2�ͻ�����ĵ���ʽΪ_______��CB2�ĵ���ʽ Ϊ________��
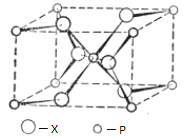
��4������ͼ��ʾ������ƿ���ռ���CB2���壬�ô�����(����һ�����Ȱ��һ������)�Ľ�������������Ѹ�ٵ���Ũ��A��B��D����Ԫ����ɵĻ��������Һ�����������������ɹ۲쵽_____��ԭ����_____________��
II��9�֣��±���Ԫ�����ڱ���һ����, ��Ա��е���������Ԫ��,��д���пհ�:
����K] | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | [m] | �� |
��1��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ�ǣ� ��������ǿ�Ļ�����ĵ���ʽ�ǣ� ��
��2������������������������Ԫ���� ��д���������������������Ʒ�Ӧ�����ӷ���ʽ ��
��3���õ���ʽ��ʾԪ���������Ļ�������γɹ��̣�
��4����ʾ�������Ļ�����ĵ���ʽ ���û��������� ���������������Ǽ����������γɵġ�
��5����������������Ԫ���γɵ����ӣ����Ӱ뾶�ɴ�С��˳����______��Ҫ�������ӷ��ű�ʾ����
��6��Ԫ�������⻯�ﳣ���º�Ԫ�����ĵ��ʷ�Ӧ�����ӷ���ʽΪ�� ��
���𰸡�I����1���� �� ̼ �� ��2�� �ڶ����ڵ���A�� ��3��![]() ��
��![]()
��4����ƿ�������ʹ� CO2��NaOH(��Һ)��ֽӴ���������Ӧ��2NaOH��CO2��Na2CO3��H2O��ʹ��ƿ��������٣�ѹǿ��С����������ѹ�����£������ʹ�
II����1��HClO4��![]() ��2��Al��Al2O3��2OH����2AlO2����H2O��
��2��Al��Al2O3��2OH����2AlO2����H2O��
��3��![]() ��4��
��4��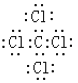 ������
������
��5��S2����Cl����O2�� ��6��Cl2��H2O��H����Cl����HClO��
�����������������I��A��B��C��D����Ԫ�صĺ˵������С��18��AԪ��ԭ�Ӻ���ֻ��1�����ӣ���A��H��B�ǵؿ��к�������Ԫ��,B��O��B��C���γ����ֻ�����CB��CB2��C���������������۾���ֵ��ȣ�CB�ж���CB2������������C��C̼Ԫ�أ�D��������Neԭ����ͬ�ĵ��Ӳ�ṹ����D��Na��
��1���������Ϸ�����֪A��B��C��D����Ԫ�ص����Ʒֱ����⡢����̼���ơ�
��2��̼Ԫ�������ڱ��е�λ���ǵڶ����ڵ���A�壻
��3����B��D����Ԫ����ɵ�D2B2�ͻ������ǹ������ƣ������ʽΪ![]() ��CB2�Ƕ�����̼������ʽΪ
��CB2�Ƕ�����̼������ʽΪ![]() ��
��
��4������CO2��NaOH(��Һ)��ֽӴ���������Ӧ��2NaOH��CO2��Na2CO3��H2O��ʹ��ƿ��������٣�ѹǿ��С����������ѹ�����£������ʹ�
II������Ԫ�������ڱ��е�λ�ÿ��ж��������ֱ���C��N��O��Na��Al��S��Cl��Ar��K��Br��
��1��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��HClO4��������ǿ�Ļ�������KOH������ʽ![]() ��
��
��2������������������������Ԫ����Al���������������������Ʒ�Ӧ�����ӷ���ʽΪAl2O3��2OH����2AlO2����H2O��
��3��Ԫ���������γɵĻ����������ƣ����γɹ��̿ɱ�ʾΪ
![]() ��
��
��4���������γɵĻ����������Ȼ�̼������ʽΪ ���û��������ɼ��Լ��γɵġ�
���û��������ɼ��Լ��γɵġ�
��5�����ӵĺ�����Ӳ���Խ�࣬���Ӱ뾶Խ���ں�������Ų���ͬ�������£����Ӱ뾶��ԭ���������������С������������������Ԫ���γɵ����ӣ����Ӱ뾶�ɴ�С��˳����S2����Cl����O2����
��6��Ԫ�������⻯�ﳣ���º�Ԫ�����ĵ��ʷ�Ӧ�����ӷ���ʽΪCl2��H2O��H����Cl����HClO��

����Ŀ������Ϊ��ɫҺ�壬��ԭ��ǿ���ױ��������м��ԣ����ᷴӦ�����Ρ�������������H2�Ʊ���![]() ��
��
�䲿��װ�ü��й��������£�
�е�/�� | �ܶ�g/mL | �ܽ��� | |
������ | 210.9 | 1.20 | ������ˮ���������Ҵ������� |
���� | 184.4 | 1.02 | ����ˮ���������Ҵ������� |
���� | 34.6 | 0.71 | ������ˮ�������������������� |
ʵ�鲽�裺
�����װ�õ������ԣ����Ӻ�C������װ�õ���ˮ��
������������ƿ�м����ʯ������������ȡ�º�ѹ��Һ©���������¶ȼơ�
����װ��A��B�������ͨ��H2һ��ʱ�䡣
����ȼB���ľƾ��ƣ����ȣ�ʹ�¶�ά����140�����з�Ӧ��
����Ӧ�����ر�װ��A��B�������������ʯ�ҡ�
���������¶ȼƵ�λ�ã��������ȣ��ռ�182��186����֣��õ��ϴ�������
�ش��������⣺
��1�����������¶ȼ�ˮ�����λ����__________��
��2�����й���ʵ��������У��������__________��
A�������ܵ���ˮӦ�ô�b����a��
B��ʵ�鿪ʼ�����¶ȼ�ˮ����Ӧ���뷴ӦҺ�У����ڿ��Ʒ�ӦҺ���¶�
C��װ��A��Ӧʹ��п�ۣ������ڼӿ�����H2������
D�������ʯ��Ŀ���Ƿ�ֹ����
��3����ʵ���в�����������˳��ߵ�����ʵ���п��ܲ����ĺ����_____________��
��4������ǰ���������м�����ʯ�ҵ�������____________________��
��5����ѧ�����ɷ�Ӧ��ɺ�ֱ������õ������Ĵ��Ȳ��ߣ�����������̣�

�����������������������ᱽ����ˮ��ȡ���ڼ�����Һ���ֱ����л��ܼ�����ȡ��������ȡ��������ȡ����Ʒ��͡�ʵ���з��͵�������__________���ڷ�Һ©���н�����ȡ��Һʱ��Ӧע�ⲻʱ��������Ŀ����____________________��
��6��������ԭ��ǿ���ױ�����������ƽ���л�ѧ����ʽ�Ļ�ѧ��������