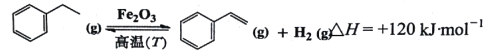
题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A ______ B_______ C _____ D ________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)画出D的核外电子排布图_____________________________________,这样排布遵循了____________原理和____________规则。
(7)用电子式表示B的硫化物的形成过程:___________________________
【答案】(1)Si;Na;P;N;(2)HNO3;NaOH(3):F;F(4)高;NH3分子间形成氢键;(5)26;四、Ⅷ;d;(6)![]() ;泡利;洪特;
;泡利;洪特;
(7)![]()
【解析】试题分析:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素.(1)由上述分析可知,A为Si、B为Na、C为P、D为N;(2)上述五种元素中,N的非金属性最强,Na的金属性最强,故HNO3的酸性最强,NaOH的碱性最强;(3)同周期自左而右,第一电离能呈增大趋势(个别除外),所以第一电离能最大的元素是F,周期自左而右,电负性增大,故电负性最大的元素是F;(4)D的氢化物NH3、C的氢化物为PH3,因为NH3分子间能形成氢键,使NH3的沸点高于PH3的;
(5)E为Fe元素,E的核外电子排布式为1s22s22p63s23p63d64s2,故核电荷数是26,Fe在周期表中处于第四周期第Ⅷ族,在周期表中处于d 区;
(6)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为:![]() ,这样排布遵循了泡利不相容原理、洪特规则;
,这样排布遵循了泡利不相容原理、洪特规则;
(7)B的硫化物为Na2S,用电子式表示形成过程:,
故答案为:![]() 。
。

【题目】IA、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构。

(1)试判断A、B、C、D四种元素的名称。A______,B_____,C______,D______。
(2)C在周期表中的位置是 。
(3)由B、D两种元素组成的D2B2型化合物的电子式为_______,CB2的电子式 为________。
(4)如右图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到_____,原因是_____________。
II(9分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族K] | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | [m] | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。