题目内容
【题目】【化学---选修3:物质结构与性质】原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构。回答下列问题:

(1)W基态原子的价电子排布式____________;Y2X2分子中Y原子轨道的杂化类型为______。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是_____________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是____________。Y60用做比金属及其合金更为有效的新型吸氢材料,其分子结构为球形32面体,它是由60个Y原子以20个六元环和12个五元环连接而成的具有30个Y=Y键的足球状空心对称分子。则该分子中σ键和π键的个数比_____;36gY60最多可以吸收标准状况下的氢气_____L。
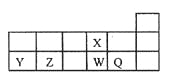
(4)元素W的一种氯化物晶体的晶胞结构如右图所示,该氯化物的化学式是___________,该晶体中W的配位数为___________。它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为_________。
【答案】(1)3d104s1 sp杂化(2)NH3分子间存在氢键(3)N2O 3:1 33.6L
(4)CuCl 4 CuCl+2HCl=H2CuCl3(或CuCl+2HCl=H2[CuCl3])
【解析】
试题分析:原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,则X是H;Y原子基态时最外层电子数是其内层电子总数的2倍,则Y是C;Z原子基态时2p原子轨道上有3个未成对的电子,所以Z是N;W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构,则W是Cu。
(1)铜基态原子的价电子排布式3d104s1;Y2X2分子是乙炔,乙炔是直线形结构,则分子中碳原子轨道的杂化类型为sp杂化。
(2) NH3分子间存在氢键,其沸点高于甲烷。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,由于互为等电子体的原子数和价电子数分别均相等,则元素Z的这种氧化物的分子式是N2O。C60分子构型为一个32面体,其中有12个五元环,20个六元环,每个碳周围有一个碳碳双键和两个碳碳单键,均为两个碳共用,所以每个碳实际占有的碳碳单键是1个,碳碳双键数为0.5个,而每个双键中有一个π键和σ键,而单键都是σ键,则该分子中σ键和π键的个数比![]() ;C60分子中含有的碳碳双键个数是30,一个碳碳双键需要1分子氢气加成,因此36gC60最多可以吸收标准状况下的氢气
;C60分子中含有的碳碳双键个数是30,一个碳碳双键需要1分子氢气加成,因此36gC60最多可以吸收标准状况下的氢气![]() 。
。
(4)根据晶胞结构可知晶胞中铜原子的个数是8×1/8+6×1/2=4,氯原子全部在晶胞内,共计4个,因此该氯化物的化学式是CuCl,该晶体中W的配位数为4。它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为CuCl+2HCl=H2CuCl3(或CuCl+2HCl=H2[CuCl3])。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】IA、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构。

(1)试判断A、B、C、D四种元素的名称。A______,B_____,C______,D______。
(2)C在周期表中的位置是 。
(3)由B、D两种元素组成的D2B2型化合物的电子式为_______,CB2的电子式 为________。
(4)如右图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到_____,原因是_____________。
II(9分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族K] | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | [m] | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。