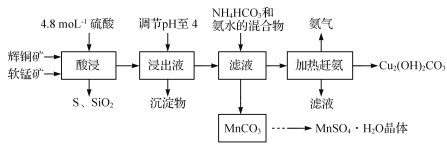
题目内容
【题目】X、Y、Z、P、Q为周期表前四周期中原子序数依次增大的元素。X原子2p能级有两个未成对电子,但没有空轨道。Y原子K层的电子数与M层的电子数的乘积等于其L层的电子数。Z与X同族。P原子的基态+2价阳离子的价电子排布为3d2。Q位于第ⅠB族。根据以上信息,回答下列问题。
(1)X的基态原子核外有 种不同运动状态的电子。
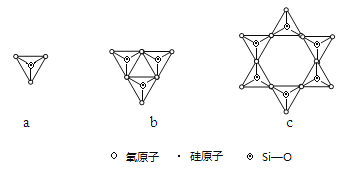
(2)Y与X可以形成多种复杂阴离子,如图所示,若其中a对应的阴离子化学式为SiO44—,则c对应的阴离子的化学式为 。
(3)Z能形成很多种含氧酸,如H2ZO3、H2ZO4。Z的某种含氧酸分子式为H2Z2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式 (配位键须注明)。
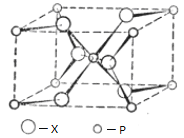
(4)P与X形成的某种晶体的晶胞结构如图所示,其晶体的化学式为 ,P的配位数为 。
(5)向盛有QZX4的溶液中加入氨水至过量,现象为 ,相关反应的离子方程式为 。NF3的空间构型是 ,NF3不易与Cu2+形成配离子,其原因是 。
【答案】(1)8;(2)Si6O1812—(3) (4)TiO2;6
(4)TiO2;6
(5)先形成蓝色沉淀,氨水过量时,沉淀溶解,得到深蓝色的透明溶液;Cu2++2NH3﹒H2O = Cu(OH)2↓+ 2NH4+,Cu(OH)2+4NH3= [Cu(NH3)4]2++ 2OH—;三角锥形;NF3分子中氟原子电负性大,非金属性强,有吸电子效应,使得氮原子上的孤电子对难于与Cu2+形成配位键。
【解析】试题分析:X、Y、Z、P、Q为周期表前四周期中原子序数依次增大的元素。X原子2p能级有两个未成对电子,但没有空轨道,X为O元素。Y原子K层的电子数与M层的电子数的乘积等于其L层的电子数,M层的电子数为4,Y为Si元素。Z与X同族,Z为S元素。P原子的基态+2价阳离子的价电子排布为3d2,P为22号元素,是Ti元素。Q位于第ⅠB族,Q为Cu元素。
(1)X为O元素,核外有8个电子,基态原子核外有8种不同运动状态的电子,故答案为:8;
(2)Si与O可以形成多种复杂阴离子,若其中a对应的阴离子化学式为SiO44—,则c对应的阴离子含有Si原子数=6,O原子数为6×(2+2×![]() )=18,根据化合价的代数和等于离子所带电荷数,该离子带12个单位的负电荷,化学式为Si6O1812—,故答案为:Si6O1812—;
)=18,根据化合价的代数和等于离子所带电荷数,该离子带12个单位的负电荷,化学式为Si6O1812—,故答案为:Si6O1812—;
(3)S能形成很多种含氧酸,如H2SO3、H2SO4。Z的某种含氧酸分子式为H2S2O7,属于二元酸,其结构中所有原子都达到稳定结构,且不存在非极性键,其结构式为 ,故答案为:
,故答案为: ;
;
(4)Ti原子数为8×![]() +1=2,O原子数为2+4×
+1=2,O原子数为2+4×![]() =4,该晶体的化学式为TiO2;与Ti原子最近且距离相等的O原子数为6,即Ti的配位数为6,故答案为:TiO2;6;
=4,该晶体的化学式为TiO2;与Ti原子最近且距离相等的O原子数为6,即Ti的配位数为6,故答案为:TiO2;6;
(5)向盛有CuSO4的溶液中加入氨水至过量,可以看到先形成蓝色沉淀,氨水过量时,沉淀溶解,得到深蓝色的透明溶液,相关反应的离子方程式为Cu2++2NH3﹒H2O = Cu(OH)2↓+ 2NH4+,Cu(OH)2+4NH3= [Cu(NH3)4]2++ 2OH—;NF3中N原子上连接有3个原子,含有1个孤电子对,采用sp3杂化,空间构型是三角锥形;NF3分子中氟原子电负性大,非金属性强,有吸电子效应,使得氮原子上的孤电子对难于与Cu2+形成配位键。故答案为:先形成蓝色沉淀,氨水过量时,沉淀溶解,得到深蓝色的透明溶液;Cu2++2NH3﹒H2O = Cu(OH)2↓+ 2NH4+,Cu(OH)2+4NH3= [Cu(NH3)4]2++ 2OH—;三角锥形;NF3分子中氟原子电负性大,非金属性强,有吸电子效应,使得氮原子上的孤电子对难于与Cu2+形成配位键。

【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置 ;
(2)写出一种由a、c、d所形成的离子化合物 (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是 ;
(3)c的单质的电子式为 。
(4)b的最简单气态氢化物的结构式是
(5)b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态 |
B.d的氢化物的稳定性强于b的氢化物 |
C.b与d形成的化合物中,b呈正价 |
D.d的氢化物的沸点高于b的氢化物 |
【题目】IA、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构。

(1)试判断A、B、C、D四种元素的名称。A______,B_____,C______,D______。
(2)C在周期表中的位置是 。
(3)由B、D两种元素组成的D2B2型化合物的电子式为_______,CB2的电子式 为________。
(4)如右图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到_____,原因是_____________。
II(9分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族K] | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | [m] | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。