题目内容
1.选择下列实验方法分离提纯物质,将分离提纯方法的序号填在横线上.A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1)F分离饱和食盐水与沙子的混合物.
(2)C从硝酸钾和氯化钠的混合溶液中获得硝酸钾.
(3)D分离水和汽油的混合物.
(4)E分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物.
(5)G除去混在乙烷中的乙烯.
(6)A提取碘水中的碘.
分析 (1)沙子不溶于水,食盐溶于水;
(2)硝酸钾和氯化钠的溶解度随温度的变化不同;
(3)水与汽油分层;
(4)二者互溶,但沸点不同;
(5)乙烯与溴水反应,而乙烷不能;
(6)碘不易溶于水,易溶于有机溶剂.
解答 解:(1)沙子不溶于水,可用过滤的方法分离,故答案为:F;
(2)硝酸钾和氯化钠的溶解度随温度的变化不同,则选择结晶法分离,故答案为:C;
(3)水与汽油分层,则选择分液法分离,故答案为:D;
(4)二者互溶,但沸点不同,则选择蒸馏法分离,故答案为:E;
(5)乙烯与溴水反应,而乙烷不能,则选择盛有溴水的洗气瓶洗气除杂,故答案为:G;
(6)碘不易溶于水,易溶于有机溶剂,则选择萃取分液提取碘水中的碘,故答案为:A.
点评 本题考查物质的分离提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,做题时注意把握物质的性质和分离的原理.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
11.某元素原子最外层只有1个电子,它跟氯元素相结合时,所形成的化学键是( )
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 可能不形成化学键 |
12.有A、B、C、D、E五种短周期元素,A原子核外电子占据5条轨道,有两个未成对电子,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C原子核外有9种不同运动状态的电子,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个.下列说法正确的是( )
| A. | 离子半径:D+>C- | |
| B. | EA2是原子晶体 | |
| C. | A和B形成的原子个数比为1:1的化合物分子是非极性分子 | |
| D. | 以上元素中形成的最高价氧化物对应的水化物酸性最强的是C |
9.为说明氯比硫的非金属性强,下列事实可作依据的是( )
| A. | HCl的溶解性强于H2S | B. | 氯的最高价为+7价 | ||
| C. | HCl的稳定性强于H2S | D. | HClO的氧化性强于H2SO4 |
6.在100mL1mol•L-1 AlCl3溶液中滴加1mol•L-1NaOH溶液,得到3.9g沉淀,则加入的NaOH溶液的体积可能是( )
| A. | 160mL | B. | 200mL | C. | 300mL | D. | 350mL |
13.下列不能用勒夏特列原理解释的是( )
| A. | 500℃时比室温更有利于合成氨的反应 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
10.在密闭容器中进行反应X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.2mol•L-1、0.1mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | Y2为0.1 mol•L-1 | B. | X2为0.1 mol•L-1 | ||
| C. | Y2为0.35 mol•L-1 | D. | Z为0.3 mol•L-1 |
11.漂白粉可由Cl2通入消石灰中制备,漂白粉的有效成分是( )
| A. | Ca(OH)2 | B. | CaCl2 | C. | Ca(ClO)2 | D. | CaCO3 |
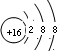 .X与Y形成的离子化合物的电子式为
.X与Y形成的离子化合物的电子式为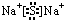 ,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.
,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.