题目内容
16.下列有关颜色变化错误的是( )| A. | 在FeCl3溶液中滴入几滴KSCN溶液,溶液变成血红色 | |
| B. | 淡黄色溴化银见光分解后变成白色 | |
| C. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程不考虑温度变化),气体颜色逐渐变深 |
分析 A.FeCl3与KSCN发生络合反应;
B.溴化银不稳定,分解生成银粉和溴;
C.碘离子能还原铁离子;
D.增大气体压强,平衡向气体体积减小方向移动.
解答 解:A.FeCl3与KSCN发生络合反应,生成血红色的Fe(SCN)3,故A正确;
B.溴化银见光分解生成的金属银不是白色,而是黑色,故B错误;
C.碘离子能还原铁离子,则向血红色的Fe(SCN)3溶液中加入少量KI固体,铁离子浓度减小,所以溶液颜色变浅,故C正确;
D.增大气体压强,平衡向气体体积减小方向移动,即反应向生成N2O4气体的方向移动,所以气体颜色逐渐变浅,因体积减小,二氧化氮的浓度反而增大,则颜色加深,故D正确.
故选B.
点评 本题考查较为综合,涉及化学平衡移动的影响因素、氧化还原反应以及元素化合物知识,题目难度不大,注意把握反应过程中物质颜色的变化.

练习册系列答案
相关题目
7.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 用丙烷和水蒸气高温下反应制取氢气,每产生0.3molCO,同时产生0.7NA个H2分子 | |
| B. | 常温常压下,16 g O3所含的电子数为8NA | |
| C. | 标准状况下 11.2 L NO与11.2 L O2混合,充分反应后所含分子数小于0.75NA | |
| D. | 1 mol/L的Ca(ClO)2溶液中含ClO-数目一定小于2NA |
4.下列有关物质性质与应用对应关系正确的是( )
| A. | 炭具有还原性,一定条件下能将二氧化硅还原为硅 | |
| B. | 二氧化硫具有还原性,能用于漂白纸浆 | |
| C. | 碳酸钠能和酸反应,常用于治疗胃酸过多 | |
| D. | 氧化铝熔点很高,用其制造的坩埚可用于熔融烧碱 |
3.被称为“智慧元素”--碘的单质及其化合物应用十分广泛,碘化钠常用于医疗和照相业等.某实验小组模拟其工业制备工艺流程如图1:

请回答下列问题:
(1)操作A包括加热浓缩、冷却结晶、过滤;用冰水洗涤的目的是洗涤除去表面可溶性杂质,同时尽量减少NaI的溶解损失;反应②的离子方程式为2Fe+IO3-+3H2O═2Fe(OH)3+I-.
(2)某同学推测得到的成品除含有NaI外,还可能有NaIO3和NaOH,并设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O2;NaIO3水溶液呈中性.
限选试剂:1mol•L-1H2SO4溶液、2mol•L-1HNO3溶液、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
(3)如图2装置Ⅰ为一种可充电电池的示意图,其中的离子交换膜只允许Na+通过,该电池充、放电的化学方程式为Na2S4+3NaI$?_{放电}^{充电}$2Na2S2+NaI3,装置Ⅱ为电解池的示意图.当闭合开关S时,电极X附近溶液先变红.此时,电极B上发生反应的电极反应式为NaI3+2Na++2e-=3NaI.电极Y上发生氧化(填“氧化”、“还原”)反应.装置Ⅱ溶液的体积为100mL,电解结束后若X极生成1.12L(已换算成标准状况)气体,则此时溶液的pH=14(假设溶液体积没有变化).

请回答下列问题:
(1)操作A包括加热浓缩、冷却结晶、过滤;用冰水洗涤的目的是洗涤除去表面可溶性杂质,同时尽量减少NaI的溶解损失;反应②的离子方程式为2Fe+IO3-+3H2O═2Fe(OH)3+I-.
(2)某同学推测得到的成品除含有NaI外,还可能有NaIO3和NaOH,并设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O2;NaIO3水溶液呈中性.
限选试剂:1mol•L-1H2SO4溶液、2mol•L-1HNO3溶液、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | |
| 取少量溶液于试管A中,加入足量的1mol•L-1H2SO4 | 溶液呈蓝色 | 溶液中含IO3- |
| 另取少量溶液于试管B中,滴入几滴酚酞溶液 | 溶液变红 | 溶液中含大量OH- |
20.某元素二价阴离子核外有18个电子,质量数为32,该元素氢化物1mol含中子数( )
| A. | 12 mol | B. | 14 mol | C. | 16 mol | D. | 18 mol |
 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.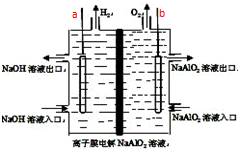 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”)
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”) 如图所示,U型管的左端被水和胶塞封闭甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间.
如图所示,U型管的左端被水和胶塞封闭甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将封闭有甲烷和氯气的混和气体的装置放置在有光亮的地方,让混和气体缓慢的反应一段时间.