题目内容
1.(1)物质的转化关系如图1所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化.有的反应可能在水溶液中进行,有的反应中反应物和生成物未全部给出,反应条件也未注明.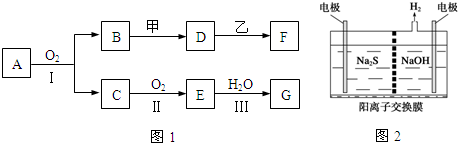
若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性.则
①1.7g A与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8kJ/mol.
②B与甲反应的离子方程式是 2Na2O2+2H2O=4Na++4OH-+O2↑.
③D的水溶液和F的水溶液中由水电离出的c(OH-)(d)(填字母序号).
(a).前者大 (b).后者大 (c).一样大 (d).不知浓度,无法比较
(2)将烧碱吸收H2S后的溶液加入如图2所示的电解池的阳极区进行电解.电解过程中阳极区发生如下反应:S2--2e-═S、(x-1)S+S2-═Sx2-
①写出电解时阴极的电极反应式:2H2O+2e-=H2↑+2OH-;
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成Sx2-+2H+=(x-1)S↓+H2S↑.
分析 (1)甲为一种淡黄色固体,且为化合物,应为Na2O2,若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成,G为酸,应为HNO3(或HCl)和NH3的反应,由于G是由A经过两步氧化后与水反应得到的,所以G为HNO3,生成NH4NO3,且A能与O2反应,应为NH3,则C为NO,E为NO2,B为H2O,D、F的溶液均呈碱性,过氧化钠与水反应得到D为NaOH,乙在G的浓溶液中发生钝化,则乙为铝或铁,能与NaOH反应的金属则为Al,所以乙为Al,F为NaAlO2;
(2)①阴极上水电离的氢离子放电生成氢气与氢氧根离子;
②电解后阳极区离子为Sx2-,酸性条件下,发生歧化反应反应生成硫单质和硫化氢.
解答 解:(1)甲为一种淡黄色固体,且为化合物,应为Na2O2,若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成,G为酸,应为HNO3(或HCl)和NH3的反应,由于G是由A经过两步氧化后与水反应得到的,所以G为HNO3,生成NH4NO3,且A能与O2反应,应为NH3,则C为NO,E为NO2,B为H2O,D、F的溶液均呈碱性,过氧化钠与水反应得到D为NaOH,乙在G的浓溶液中发生钝化,则乙为铝或铁,能与NaOH反应的金属则为Al,所以乙为Al,F为NaAlO2,则:
①1.7g 氨气即为0.1mol,与O2反应生成气态的B和C时放出22.67kJ热量,则4mol氨气反应放出热量为22.67kJ×$\frac{4mol}{0.1mol}$=906.8kJ,该反应的热化学方程式为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8kJ/mol,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8kJ/mol;
②水与过氧化钠反应生成氢氧化钠与氧气,反应离子方程式是为:2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
③不知道NaOH水溶液、NaAlO2的水溶液浓度,无法比较由水电离出的c(OH-)浓度大小,故选:(d);
(2)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气,电极反应式为 2H2O+2e-=H2↑+2OH-,
故答案为:2H2O+2e-=H2↑+2OH-;
②电解后阳极区离子为Sx2-,酸性条件下,发生歧化反应反应生成硫单质和硫化氢,反应离子方程式为:Sx2-+2H+=(x-1)S↓+H2S↑,故答案为:Sx2-+2H+=(x-1)S↓+H2S↑.
点评 本题考查无机物的推断与电解原理,属于拼合型题目,(1)中物质的颜色、特殊性质、反应现象为推断的突破口,题目侧重于学生分析能力与元素化合物知识的考查,难度中等.

 名校课堂系列答案
名校课堂系列答案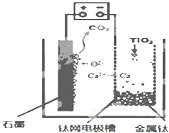 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )| A. | 由TiO2制得1mol 金属Ti,理论上外电路转移2NA电子 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 | |
| D. | 在制备金属钛前后,整套装置中CaO的总量减少 |
| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 1mol Cl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等 | |
| C. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA | |
| D. | 0.5mol•L-1 Na2SO4溶液中含有的阴、阳离子总数为1.5NA |
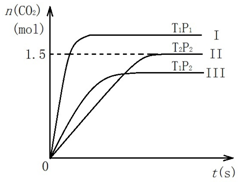 在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )
在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )| A. | 温度T2>T1 | B. | 压强P2>P1 | ||
| C. | II曲线表示NO平衡转化率为25% | D. | 该反应的焓变△H<0 |
| A. | 用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| B. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O | |
| C. | NH4Al(SO4)2溶液与过量NaOH溶液混合加热:NH4++Al3++4OH-═Al(OH)3↓+NH3↑+H2O | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O |
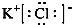 ;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).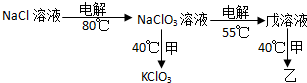
 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.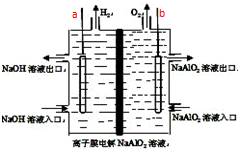 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”)
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极):该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑.电解池阳极室发生的电极反应式是4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,该离子膜为阳离子交换膜(填“阴”或“阳”)