题目内容
18.有A、B、C、D四种原子序数依次增大的短周期元素,其中只有C为金属元素,A和C的最外层电子数相同,C和D的质子数之和是A和B质子数之和的3倍,D的氧化物是形成酸雨的主要气体,下列说法不正确的是( )| A. | B和C可形成一种含不同类型的化学键的碱性氧化物 | |
| B. | D2-离子在水溶液中与Al3+、H+均不能大量共存 | |
| C. | A2B的稳定性强于A2D的稳定性 | |
| D. | A2D和DB2可发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为2:1 |
分析 短周期主族元素A、B、C、D的原子序数依次增大,其中只有C为金属元素,C的最外层电子数和A相等,则A、C为同族元素,则A、C可能处于IA族或ⅢA族,若处于ⅢA族,A为硼元素,则B的原子序数大于5,设B的原子序数为x,D的原子序数为y,则3×(5+x)=15+3x=13+y,由于x>5,则D的原子序数大于18,不符合题意,A、C只能处于IA族,所以A为氢,C为钠,结合3×(1+x)=11+y,只能x=8,y=16,故B为氧元素,D为硫元素,D的氧化物二氧化硫是形成酸雨的主要气体,据此答题.
解答 解:短周期主族元素A、B、C、D的原子序数依次增大,其中只有C为金属元素,C的最外层电子数和A相等,则A、C为同族元素,则A、C可能处于IA族或ⅢA族,若处于ⅢA族,A为硼元素,则B的原子序数大于5,设B的原子序数为x,D的原子序数为y,则3×(5+x)=15+3x=13+y,由于x>5,则D的原子序数大于18,不符合题意,A、C只能处于IA族,所以A为氢,C为钠,结合3×(1+x)=11+y,只能x=8,y=16,故B为氧元素,D为硫元素,D的氧化物二氧化硫是形成酸雨的主要气体.
A.B和C可形成一种含不同类型的化学键的为过氧化钠,过氧化钠不属于碱性氧化物,故A错误;
B.S2-离子与Al3+发生双水解,与H+反应生成硫化氢,不能大量共存,故B正确;
C.由于非金属性O>S,故H2O的稳定性强于H2S的稳定性,故C正确;
D.H2S和SO2发生反应:2H2S+SO2=3S↓+H2O,硫化氢为还原剂生成的硫为氧化产物,二氧化硫为氧化剂,得到硫为还原产物,故氧化产物与还原产物的物质的量之比为2:1,故D正确,
故选:A.
点评 本题考查原子结构与位置关系,推断元素是解题关键,注意对元素化合物性质的掌握,难度中等.

| A. | 用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| B. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O | |
| C. | NH4Al(SO4)2溶液与过量NaOH溶液混合加热:NH4++Al3++4OH-═Al(OH)3↓+NH3↑+H2O | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O |
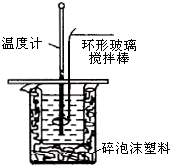 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l);△H=-113.7kJ•mol-1.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
| A. | 用丙烷和水蒸气高温下反应制取氢气,每产生0.3molCO,同时产生0.7NA个H2分子 | |
| B. | 常温常压下,16 g O3所含的电子数为8NA | |
| C. | 标准状况下 11.2 L NO与11.2 L O2混合,充分反应后所含分子数小于0.75NA | |
| D. | 1 mol/L的Ca(ClO)2溶液中含ClO-数目一定小于2NA |

请回答下列问题:
(1)操作A包括加热浓缩、冷却结晶、过滤;用冰水洗涤的目的是洗涤除去表面可溶性杂质,同时尽量减少NaI的溶解损失;反应②的离子方程式为2Fe+IO3-+3H2O═2Fe(OH)3+I-.
(2)某同学推测得到的成品除含有NaI外,还可能有NaIO3和NaOH,并设计如下方案进行检验,实验结果表明其推测正确.
已知:IO3-+5I-+6H+=3I2+3H2O2;NaIO3水溶液呈中性.
限选试剂:1mol•L-1H2SO4溶液、2mol•L-1HNO3溶液、淀粉溶液、酚酞试液、石蕊试液、蒸馏水.其它仪器和用品自选.
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | |
| 取少量溶液于试管A中,加入足量的1mol•L-1H2SO4 | 溶液呈蓝色 | 溶液中含IO3- |
| 另取少量溶液于试管B中,滴入几滴酚酞溶液 | 溶液变红 | 溶液中含大量OH- |
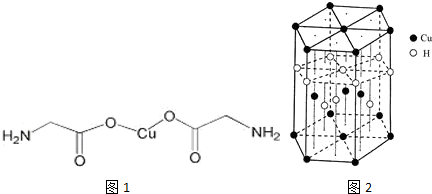
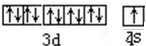 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.
,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N. ;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).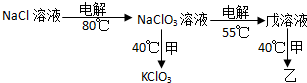
 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.