题目内容
【题目】(一)实验室利用如图装置进行中和热的测定。回答下列问题:
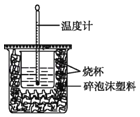
(1)该图中有一处未画出,它是_____(填仪器名称)。
(2)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则根据此实验的数据书写中和热的热化学方程式中的△H将_____(填“偏大”“偏小”或“不变”),原因是_____。
(3)利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,设溶液的密度均为1 g/cm3,中和后溶液的比热容c=4.18 J/(g℃),请根据实验数据计算,中和热△H=_____ (取小数点后一位)。
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
盐酸 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.4 |
2 | 27.0 | 27.4 | 27.2 | 31.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
(4)上述(3)中的结果与中和热的理论值有偏差,产生偏差的原因可能是_____
a.实验装置保温、隔热效果差
b.使用环形玻璃搅拌棒搅拌,使其充分反应
c.分多次把NaOH溶液倒入盛有稀盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
(二)某学生用0.2000molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固体好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_____。
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)_____。
(3)判断滴定终点的现象是:_____。
(4)如图是某次滴定时的滴定管中的液面,其读数为_____mL。

(5)根据下列数据:请计算待测盐酸溶液的浓度:_____。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.30 | 20.40 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.00 | 24.30 |
【答案】环形玻璃搅拌棒 偏小 NaOH固体溶解放热,中和热的△H为负值 -55.2kJ/mol acd ① 偏大 偏小 当滴入最后一滴氢氧化钠溶液,溶液由无色变为粉红色,且半分钟内不褪色 22.60 0.2150mol/L
【解析】
(一)(1)根据量热计的构造判断该装置缺少仪器;
(2)NaOH固体溶于水放热,使反应热偏大,结合中和热的热化学方程式中的△H为负值分析解答;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=mc△T计算反应放出的热量,然后根据△H=-![]() kJ/mol计算出反应热;
kJ/mol计算出反应热;
(4)上述(3)中的中和热比中和热的理论值小。根据实验操作对放出的热量的影响分析判断;
(二)(1)碱式滴定管在装液前没有用所装液体进行润洗;没有用标准液润洗,导致标准液浓度减小,滴定过程中消耗标准液体积偏大;
(2)滴定终点时,滴定管尖嘴有气泡,导致消耗消耗标准液体积偏小;
(3)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)滴定管的最小读数为0.01mL,滴定管0刻度在上方,结合图示液面判断溶液体积;
(5)先根据数据的有效性,舍去第3组数据,然后求出1、2组平均消耗V(NaOH),接着根据c(待测)=![]() 计算。
计算。
(一)(1)根据量热计的构造可知,该装置的缺少的仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)NaOH固体溶于水放热,使反应放出的热量偏多,但中和热的△H为负值,所以反应热偏大,△H偏小,故答案为:偏小;NaOH固体溶解放热,中和热的△H为负值;
(3)3次温度差分别为:3.3℃,4.1℃,3.3℃,第2组数据偏差较大,舍去,温度差平均值为3.3℃,50mL0.50mol/L稀盐酸与50mL0.55mol/L氢氧化钠溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/mL=110g,温度变化的值为△T=3.3℃,则生成0.025mol水放出的热量为Q=mc△T=100g×4.18J/(g℃)×3.3℃=1.3794kJ,所以实验测得的中和热△H=-![]() =-55.2kJ/mol,故答案为:-55.2kJ/mol;
=-55.2kJ/mol,故答案为:-55.2kJ/mol;
(4)上述(3)中的中和热比中和热的理论值小。a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a选;b.使用环形玻璃搅拌棒搅拌,使其充分反应,不会对结果产生影响,故b不选;c.分多次把NaOH溶液倒入盛有稀盐酸的小烧杯中,会导致热量损失大,温度差小,中和热的数值偏低,故c选;d.温度计测定NaOH溶液起始温度后直接插入稀盐酸测温度,盐酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d选;故答案为:acd。
(二)(1)碱式滴定管在装液前应用所装液体进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上,碱式滴定管未用标准氢氧化钠溶液润洗,就直接注入标准NaOH溶液,导致标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=![]() 可知,c(标准)偏大,故答案为:①;偏大;
可知,c(标准)偏大,故答案为:①;偏大;
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,造成V(标准)读数偏小,根据c(待测)=![]() 可知,c(待测)偏小,故答案为:偏小;
可知,c(待测)偏小,故答案为:偏小;
(3)滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,所以当滴入最后一滴氢氧化钠溶液,溶液由无色变为粉红色,且半分钟内不褪色,说明达到滴定终点,故答案为:当滴入最后一滴氢氧化钠溶液,溶液由无色变为粉红色,且半分钟内不褪色;
(4)根据图示可知,滴定管中的液面读数为22.60mL,故答案为:22.60;
(5)三次滴定消耗的体积为:20.10mL,20.20mL,22.30,舍去第3组数据,1、2组平均消耗V(NaOH)=![]() =20.15mL,c(待测)=
=20.15mL,c(待测)=![]() =0.2150molL-1,故答案为:0.2150mol/L。
=0.2150molL-1,故答案为:0.2150mol/L。

 阅读快车系列答案
阅读快车系列答案