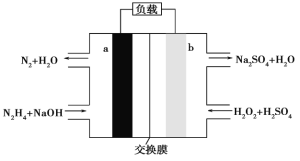
题目内容
【题目】(1)根据要求回答下列问题:
①干冰与CO2;②白磷与红磷;③![]() Cl与
Cl与![]() Cl;④液氯与氯水;⑤
Cl;④液氯与氯水;⑤![]() 与
与 。在上述各组物质中:
。在上述各组物质中:
互为同位素的是__________________;
互为同素异形体的是__________________;
互为同分异构体的是__________________;
属于同种物质的是__________________。(填序号,下同)
(2)现有以下六种物质形成的晶体:a.NH4Cl;b.SiO2;c.Na2O2;d.干冰;e.C60;f.Ne请用相应字母填空:
属于分子晶体的是__________________;属于共价化合物的是__________________;属于离子化合物的是___________;熔化时只需要破坏共价键的是__________________;既含有离子键又含有非极性共价键的是__________________;不存在化学键的是__________________。
【答案】③ ② ⑤ ① def bd ac b c f
【解析】
(1)根据同一物质分子式和结构相同、同位素是质子数相同而中子数不同的原子、同素异形体是由同一元素组成的不同性质的单质、同分异构体是分子式相同而结构不同的化合物分析判断;
(2)分子晶体的构成微粒是分子,作用力是分子间作用力;共价化合物是原子之间以共价键形成的化合物;原子晶体构成微粒是原子,作用力是共价键;离子晶体是阴阳离子之间以离子键结合形成的化合物,若阴离子或阳离子为复杂离子,则还含有共价键;若物质构成微粒是单原子分子,则物质内不含有化学键。
(1)①干冰是固态CO2,因此干冰与CO2属于同一物质;
②白磷与红磷是由P元素组成的不同性质的单质,二者互为同素异形体;
③3517Cl与3717Cl质子数都是17,中子数分别是18、20,二者互为同位素;
④液氯是液态Cl2,属于纯净物,而氯水是氯气的水溶液,其中含有Cl2、HCl、HClO、H2O等多种组分,属于混合物;
⑤![]() 名称为2,3-二甲基丁烷,分子式为C6H14,
名称为2,3-二甲基丁烷,分子式为C6H14,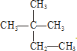 名称为2,2-二甲基丁烷,分子式为C6H14,二者分子式相同,结构不同,互为同分异构体。
名称为2,2-二甲基丁烷,分子式为C6H14,二者分子式相同,结构不同,互为同分异构体。
故在上述各组物质中,互为同位素的序号是③;互为同素异形体序号是②;互为同分异构体的序号是⑤;属于同种物质的序号是①
(2) a.NH4Cl由NH4+与Cl-之间通过离子键结合形成离子晶体,在阳离子NH4+中含有共价键,因此NH4Cl中含有离子键、共价键;
b.SiO2是由Si原子与O原子通过共价键形成的原子晶体,构成微粒是原子,作用力为共价键,属于共价化合物;
c.Na2O2是由Na+与O22-之间通过离子键结合形成的离子化合物,在O22-中含有非极性共价键,因此其中含有的化学键为离子键、共价键;
d.干冰是固体CO2,是由CO2分子通过分子间作用力结合形成的分子晶体,在分子内含有共价键,属于共价化合物;
e.C60是由分子通过分子间作用力形成的分子晶体,分子内C原子之间以共价键结合,由于只含有C元素,属于单质;
f.Ne是由分子通过分子间作用力构成的分子晶体,一个Ne原子就是一个分子,不存在化学键。
故在上述物质中,属于分子晶体的序号是def;属于共价化合物的序号是bd;属于离子化合物的是ac;熔化时只需要破坏共价键的序号是b;既含有离子键又含有非极性共价键的是c;不存在化学键的是f。

【题目】(一)实验室利用如图装置进行中和热的测定。回答下列问题:
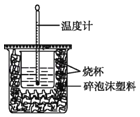
(1)该图中有一处未画出,它是_____(填仪器名称)。
(2)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则根据此实验的数据书写中和热的热化学方程式中的△H将_____(填“偏大”“偏小”或“不变”),原因是_____。
(3)利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,设溶液的密度均为1 g/cm3,中和后溶液的比热容c=4.18 J/(g℃),请根据实验数据计算,中和热△H=_____ (取小数点后一位)。
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
盐酸 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.4 |
2 | 27.0 | 27.4 | 27.2 | 31.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
(4)上述(3)中的结果与中和热的理论值有偏差,产生偏差的原因可能是_____
a.实验装置保温、隔热效果差
b.使用环形玻璃搅拌棒搅拌,使其充分反应
c.分多次把NaOH溶液倒入盛有稀盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
(二)某学生用0.2000molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固体好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_____。
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)_____。
(3)判断滴定终点的现象是:_____。
(4)如图是某次滴定时的滴定管中的液面,其读数为_____mL。

(5)根据下列数据:请计算待测盐酸溶液的浓度:_____。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.30 | 20.40 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.00 | 24.30 |