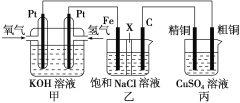
��Ŀ����
����Ŀ����һƿ��ɫ�������Һ�����п��ܺ�NH4+��K����Na����Mg2����H����Cu2����CO32-��I���е�һ�ֻ��֣�ȡ����Һ��������ʵ�飺
����pH��ֽ���飬������Һ��ǿ���ԡ�
��ȡ������Һ����μ���NaOHϡ��Һ��ʹ��Һ������ת��Ϊ���ԣ��ڵμӹ����м��μ���Ϻ���Һ�о��������ɡ�
�۽��ڵõ��ļ�����Һ���ȣ�������ų�����������ʹʪ��ĺ�ɫʯ����ֽ������
��������ʵ����ʵ�ش��������⣺
��1������Һ�У��϶����ڵ�������________���϶������ڵ�������________������ȷ���Ƿ���ڵ�������________��
��2��д��ʵ����е����ӷ���ʽ��___________________________________________________��
���𰸡�![]() ��H����I�� Mg2����Cu2����
��H����I�� Mg2����Cu2����![]() K����Na��
K����Na�� ![]()
��������
��ɫ��Һ��һ����������ɫ��Cu2+��
����pH��ֽ���飬������Һ��ǿ���ԣ���һ�����ڴ�����H+��̼��������������ӷ�Ӧ������һ��������![]() ��������Һ�������ж�һ�����ڵ����ӣ�
��������Һ�������ж�һ�����ڵ����ӣ�
����ȡ������Һ����μ���ϡNaOH��Һ��ʹ��Һ��������ת��Ϊ���ԣ��ڵμӹ����м��μ���Ϻ���Һ�о��������ɣ���һ��������Mg2+��
�۽��ڵõ��ļ�����Һ���ȣ�������ų�����������ʹʪ��ĺ�ɫʯ����ֽ������������Ϊ��������һ������![]() ��
��
����Һ���Ƿ���K����Na������ȷ�����������Ϸ������н��
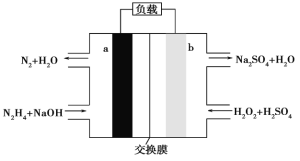
��1����������������֪���϶����ڵ������У�![]() ��H����I�����϶������ڵ������У���Mg2����Cu2����
��H����I�����϶������ڵ������У���Mg2����Cu2����![]() ������ȷ���Ƿ���ڵ������У�K����Na����
������ȷ���Ƿ���ڵ������У�K����Na����
��2��ʵ���Ϊ![]() ��OH-��Ӧ�ڼ��������²��������ķ�Ӧ���䷴Ӧ���ӷ���ʽΪ��
��OH-��Ӧ�ڼ��������²��������ķ�Ӧ���䷴Ӧ���ӷ���ʽΪ��![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����£�����ʵ����������������۲�������ǣ� ��
ѡ�� | ���������� | ���� |
A | ��pH��ֽ���0.1mol/LCH3COOH��ҺpHԼΪ3 | CH3COOH��������� |
B | ��ij��ɫ��Һ�м�������ϡ���ᣬ������ɫ��ζ���壻�ٽ�������ͨ�����ʯ��ˮ��������ɫ���� | ��Һ�п��ܺ���CO |
C | ��pH�Ʋⶨ��ͬŨ�ȵ�CH3COONa��Һ��NaClO��Һ��pH��ǰ�ߵ�pHС�ں��ߵ� | HClO����������CH3COOH |
D | ��2mL1mol/LNaOH��Һ�м���1mL0.1mol/LMgCl2��Һ��������ɫ�������ټ���1mL0.1mol/LFeCl3��Һ���������ɫ���� | Mg(OH)2����ת��ΪFe(OH)3���� |
A.AB.BC.CD.D
����Ŀ����һ��ʵ����������ͼװ�ý����к��ȵIJⶨ���ش��������⣺
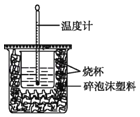
��1����ͼ����һ��δ����������_____�����������ƣ���
��2�������0.50 mol/L��������������ƹ������ʵ�飬����ݴ�ʵ���������д�к��ȵ��Ȼ�ѧ����ʽ�еġ�H��_____������ƫ������ƫС����������������ԭ����_____��
��3������50 mL 0.50 mol/L��ϡ������50 mL 0.55 mol/L��ϡ����������Һ����ʵ�飬����Һ���ܶȾ�Ϊ1 g/cm3���кͺ���Һ�ı�����c��4.18 J/��g�棩�������ʵ�����ݼ��㣬�к��ȡ�H��_____ ��ȡС�����һλ����
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | ||
���� | NaOH | ƽ��ֵ | ||
1 | 26.2 | 26.0 | 26.1 | 29.4 |
2 | 27.0 | 27.4 | 27.2 | 31.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
��4��������3���еĽ�����к��ȵ�����ֵ��ƫ�����ƫ���ԭ�������_____
a��ʵ��װ�ñ��¡�����Ч����
b��ʹ�û��β�����������裬ʹ���ַ�Ӧ
c���ֶ�ΰ�NaOH��Һ����ʢ��ϡ�����С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳⶨ������Һ���¶�
������ijѧ����0.2000molL��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ�����Ϊ���¼�����
��������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶�������
�ڹ���õζ��ܲ�ʹ�ζ��ܼ������Һ��
�۵���Һ������0������0���̶������£������¶���
����ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ
���ñ�Һ�ζ����յ㣬���µζ���Һ�������
��ش�
��1�����ϲ����д�����ǣ����ţ�_____���ô�������ᵼ�²ⶨ���������ƫ��������ƫС��������Ӱ������_____��
��2��������У��ڼ��µζ���Һ�����ʱ���ζ��ܼ��������ݣ������²ⶨ���������ƫ��������ƫС��������Ӱ������_____��
��3���жϵζ��յ�������ǣ�_____��
��4����ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ_____mL��

��5�������������ݣ���������������Һ��Ũ�ȣ�_____��
�ζ����� | ���������mL�� | ���ռ������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 20.00 | 0.30 | 20.40 |
�ڶ��� | 20.00 | 4.00 | 24.20 |
������ | 20.00 | 2.00 | 24.30 |