题目内容
【题目】若用AG表示溶液的酸度(acidity grade),AG的定义为AG = lg[![]() ].室温下实验室中用0.01molL-1的氢氧化钠溶液滴定20.00mL 0.01molL-1的一元弱酸HA,滴定过程如图所示,下列叙述正确的是( )
].室温下实验室中用0.01molL-1的氢氧化钠溶液滴定20.00mL 0.01molL-1的一元弱酸HA,滴定过程如图所示,下列叙述正确的是( )

A. 室温下,弱酸HA的电离常数约为10-5
B. A点时加入氢氧化钠溶液的体积为20.00mL
C. 若B点为40mL,所得溶液中:c(OH-) = c(A-)+c(HA)+c(H+)
D. 反应过程中一定存在:0.01molL-1+c(OH-)=c(Na+)+c(HA)
【答案】A
【解析】
A.室温下,醋酸的AG=lg[![]() ]=7,即
]=7,即![]() =107,而水的离子积K=c(H+)c(OH﹣)=10﹣14,两式联立可知:c(H+)=10﹣3.5,而在醋酸溶液中,c(CH3COO﹣)≈c(H+)=10﹣3.5,故电离平衡常数K=
=107,而水的离子积K=c(H+)c(OH﹣)=10﹣14,两式联立可知:c(H+)=10﹣3.5,而在醋酸溶液中,c(CH3COO﹣)≈c(H+)=10﹣3.5,故电离平衡常数K=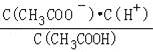 =
=![]() =10﹣5,故A正确;
=10﹣5,故A正确;
B.A点的AG=lg[![]() ]=0,即
]=0,即![]() =1,即c(H+)=c(OH﹣),溶液显中性,而当加入氢氧化钠溶液20mL时,恰好和醋酸完全中和,得到醋酸钠溶液,溶液显碱性,故B错误;
=1,即c(H+)=c(OH﹣),溶液显中性,而当加入氢氧化钠溶液20mL时,恰好和醋酸完全中和,得到醋酸钠溶液,溶液显碱性,故B错误;
C.当B点加入NaOH溶液为40mL时,所得的为等浓度的CH3COONa和NaOH的混合溶液,根据电荷守恒和物料守恒可知:c(OH﹣)+c(CH3COO﹣)=c(Na+)+c(H+),c(Na+)=2[c(CH3COO﹣)+c(CH3COOH)],两式联立可得:c(OH﹣)=c(CH3COO﹣)+c(H+)+2c(CH3COOH),故C错误;
D.反应过程中根据电荷守恒一定存在:c(OH﹣)+c(CH3COO﹣)=c(Na+)+c(H+),但由于两溶液混合后溶液体积发生改变,故c(CH3COOH)+c(CH3COO﹣)<0.01mol/L,故0.01molL﹣1+c(OH﹣)>c(Na+)+c(H+)+c(CH3COOH),0.01molL﹣1+c(OH﹣)=c(Na+)+c(CH3COOH)不成立,故D错误;
故答案选A。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案