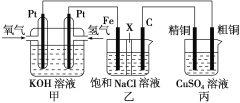
题目内容
【题目】下列叙述中,正确的是![]()
![]()
A.常温下,![]() 的甲酸溶液的
的甲酸溶液的![]() 与
与![]() 的氨水溶液中由水电离产生的
的氨水溶液中由水电离产生的![]() 相等
相等
B.中和 ![]() 醋酸与中和
醋酸与中和 ![]() 的醋酸所需同种碱溶液的物质的量不同
的醋酸所需同种碱溶液的物质的量不同
C.向![]() 溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强
溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强
D.向饱和石灰水中加入少量CaO,恢复至室温后溶液中![]() 增大,导电能力增强
增大,导电能力增强
【答案】A
【解析】
A.常温下,![]() 的甲酸溶液中
的甲酸溶液中![]() ,
,![]() 的氨水中的
的氨水中的![]() ,酸和碱均抑制水的电离,由水电离产生的
,酸和碱均抑制水的电离,由水电离产生的![]() 均为
均为![]() ,故A正确;
,故A正确;
B.中和不同浓度的醋酸时,所需NaOH物质的量与醋酸的物质的量成正比,当![]() 醋酸与
醋酸与![]() 醋酸体积分别为10mL和100mL时,其物质的量相等都是
醋酸体积分别为10mL和100mL时,其物质的量相等都是![]() ,所以中和时需要NaOH的物质的量相等,故B错误;
,所以中和时需要NaOH的物质的量相等,故B错误;
C.![]() 溶液中逐渐加入适量NaOH固体生成氯化钠和氨气,溶液中离子浓度变化不大,所以溶液的导电性变化不大,故C错误;
溶液中逐渐加入适量NaOH固体生成氯化钠和氨气,溶液中离子浓度变化不大,所以溶液的导电性变化不大,故C错误;
D.饱和溶液的浓度与温度有关,向饱和石灰水中加入少量CaO,恢复至室温后,温度没有变化,所以仍为饱和溶液,溶液中![]() 不变,导电能力不变,故D错误。
不变,导电能力不变,故D错误。
答案选A。

【题目】(一)实验室利用如图装置进行中和热的测定。回答下列问题:
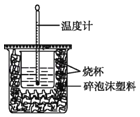
(1)该图中有一处未画出,它是_____(填仪器名称)。
(2)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则根据此实验的数据书写中和热的热化学方程式中的△H将_____(填“偏大”“偏小”或“不变”),原因是_____。
(3)利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,设溶液的密度均为1 g/cm3,中和后溶液的比热容c=4.18 J/(g℃),请根据实验数据计算,中和热△H=_____ (取小数点后一位)。
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
盐酸 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.4 |
2 | 27.0 | 27.4 | 27.2 | 31.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
(4)上述(3)中的结果与中和热的理论值有偏差,产生偏差的原因可能是_____
a.实验装置保温、隔热效果差
b.使用环形玻璃搅拌棒搅拌,使其充分反应
c.分多次把NaOH溶液倒入盛有稀盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
(二)某学生用0.2000molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固体好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_____。
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)_____。
(3)判断滴定终点的现象是:_____。
(4)如图是某次滴定时的滴定管中的液面,其读数为_____mL。

(5)根据下列数据:请计算待测盐酸溶液的浓度:_____。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.30 | 20.40 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.00 | 24.30 |