题目内容
4.无水CuSO4在500℃以上按下式分解:CuSO4→CuO+SO3↑+SO2↑+O2↑,某同学为测定一定量的CuSO4受热分解所产生的SO3、SO2、O2的物质的量,从而通过计算来确定该条件下CuSO4分解方程式中各物质的化学计量数.实验的主要仪器如下: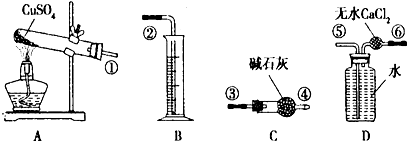
实验所测得数据及有关事项如下:
a.准确称取6.40g无水CuSO4;
b.装置C在实验结束时增重2.88g;
c.实验结束后,测量量筒中水的体积后,折算成排出水的气体的体积(标准状况下)为224mL.
(1)按装置从左至右的方向,各仪器接口的连接顺序为①③④⑥⑤②(用圆圈内数字表示,不重复使用).
(2)实验前,还须向盛满水的D装置中通入O2(所需的O2另用其他方法制取)使之达到饱和,这样操作的目的是降低O2在水中的溶解度,减少实验误差.
(3)假设CuSO4完全分解且所有气体全被吸收或排出,通过题中所给的数据计算,CuSO4完全分解所得SO3的物质的量是0.02mol,该条件下无水CuSO4分解的化学方程式是4CuSO4$\frac{\underline{\;500℃以上\;}}{\;}$4CuO+2SO3↑+2SO2↑+O2↑.
(4)若将A中分解所得的混合气直接导入一定量的NaOH溶液中,当酸性气体恰好完全被吸收,而仍有氧气逸出时,则溶液中离子浓度之间的关系可能为bcd(填序号).
a、c(SO42-)=c(SO32-)
b、c(OH-)=c(H+)
c、c(Na+)>c(SO42-)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
d、c(Na+)>c(SO42-)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
分析 (1)根据气体的制备和收集按照发生装置→气体吸收装置→排水→测量装置来组装实验仪器;
(2)水中能够溶解部分氧气,会影响测定结果,故实验前向盛满水的D装置中通入O2,使之达到饱和;
(3)根据n=$\frac{m}{M}$计算出样品硫酸铜的物质的量,根据n=$\frac{V}{{V}_{m}}$计算出分解生成氧气的物质的量;利用S原子守恒及二氧化硫、三氧化硫的总质量列式计算出二氧化硫和三氧化硫的物质的量,从而可得出硫酸铜与二氧化硫、三氧化硫、氧气的物质的量之比,最后据此写出反应方程式;
(4)二氧化硫和三氧化硫的物质的量相等,二者与氢氧化钠溶液恰好反应,反应后溶质可能为亚硫酸钠和硫酸钠的混合物,有可能为亚硫酸钠和亚硫酸氢钠的混合物,结合盐的水解原理、电荷守恒判断溶液中可能出现的离子浓度大小.
解答 解:(1)气体的制备和收集按照发生装置→气体吸收装置→排水→测量装置来安装实验仪器,按从左至右的方向,先分解制备气体,通过碱石灰吸收二氧化硫、三氧化硫,然后利用排水量气法测定氧气的体积,则各仪器接口连接顺序为:①③④⑥⑤②,
故答案为:①③④⑥⑤②;
(2)水中能够溶解少量氧气,会引进误差,所以实验前向盛满水的D装置中通入O2,使之达到饱和,可以降低O2在水中的溶解度,减少实验误差,
故答案为:降低O2在水中的溶解度,减少实验误差;
(3)准确称取6.40g无水CuSO4,硫酸铜的物质的量为:$\frac{6.40g}{160g/mol}$=0.04mol,装置C在实验结束时增重的2.88g为二氧化硫和二氧化碳的物质的量,设分解产物中含有二氧化硫xmol,含有ymol三氧化硫,则:x+y=0.04mol、64x+80y=2.88,联立解得:x=y=0.02mol,即:分解的混合气体中含有二氧化硫和二氧化碳的物质的量都是0.02mol;实验结束后,测量量筒中水的体积后,折算成排出水的气体的体积(标准状况下)为224mL,说明分解生成氧气的物质的量为:$\frac{0.224L}{22.4L/mol}$=0.01mol,则反应中硫酸铜、三氧化硫、二氧化硫和氧气的物质的量之比为:0.04mol:0.02mol:0.02mol:0.01mol=4:2:2:1,所以该反应的化学方程式为:4CuSO4$\frac{\underline{\;500℃以上\;}}{\;}$4CuO+2SO3↑+2SO2↑+O2↑,
故答案为:0.02;4CuSO4$\frac{\underline{\;500℃以上\;}}{\;}$4CuO+2SO3↑+2SO2↑+O2↑;
(4)产生的二氧化硫与三氧化硫的物质的量相等,当酸性气体恰好完全被吸收,而仍有氧气逸出时,说明二氧化硫没有完全被氧化,反应后溶质为硫酸钠、亚硫酸钠或硫酸钠、亚硫酸氢钠,
a.于溶液中二氧化硫没有完全反应,则一定满足c(SO42-)<c(SO32-),故a错误;
b.溶液中溶质为亚硫酸钠、硫酸钠和亚硫酸氢钠时,溶液中可能为中性,则:c(OH-)=c(H+),故b正确;
c.反应后溶质为亚硫酸钠、硫酸钠的混合液时,亚硫酸根离子部分水解,溶液显示碱性,则满足:c(Na+)>c(SO42-)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故c正确;
d.溶质为亚硫酸氢钠和硫酸钠时,亚硫酸氢根离子的水解程度大于其电离程度,则溶液呈酸性,此时满足:c(Na+)>c(SO42-)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故d正确;
故答案为:b、c、d.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,涉及装置连接、化学方程式书写、离子浓度大小比较、化学计算等知识,明确实验目的为解答关键,试题培养了学生的分析、理解能力及化学实验能力,(4)为易错点,需要明确反应后溶质组成.

| A. | NaOH溶液中混有Ba(OH)2 (CuSO4) | B. | Cu(NO3)2中混有AgNO3 (Cu粉) | ||
| C. | CO中混有CO2(炽热的炭) | D. | CO2中混有HCl气体 (NaOH溶液) |
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做新制氢氧化铜反应实验--检验淀粉是否水解 | |
| B. | 向1-溴丙烷中加入氢氧化钠溶液并加热,再滴加硝酸银和稀硝酸溶液--检验有机物中是否含有溴元素 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 向含苯酚的苯溶液中滴加浓溴水,过滤--除去苯中的苯酚 |
| A. | 1000 ml | B. | 500 ml | C. | 1500 ml | D. | 100 ml |
| A. | 直径介于1 nm~100 nm之间的微粒称为胶体 | |
| B. | 制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 渗析是鉴别溶液和胶体的最简便的方法 |
| A. | 正反应速率加快 | B. | 正反应速率减慢 | C. | 逆反应速率加快 | D. | 无法判断 |
| A. | 原硅酸是白色胶状物,失去部分水后变成白色粉末状硅酸 | |
| B. | SiO2分子由一个硅原子和两个氧原子构成 | |
| C. | SiO2溶于水后则慢慢生成硅酸 | |
| D. | SiO2既能与酸反应,又能与强碱反应,故它是两性氧化物 |

| A. | 1 mol该物质与足量溴水反应消耗2 mol Br2 | |
| B. | 该物质能与碳酸氢钠溶液反应放出CO2 | |
| C. | 该物质的所有碳原子可能在同一平面 | |
| D. | 该物质与足量氢气发生加成反应后所得物质的化学式为C15H28O2 |
