题目内容
16.下列说法正确的是( )| A. | 原硅酸是白色胶状物,失去部分水后变成白色粉末状硅酸 | |
| B. | SiO2分子由一个硅原子和两个氧原子构成 | |
| C. | SiO2溶于水后则慢慢生成硅酸 | |
| D. | SiO2既能与酸反应,又能与强碱反应,故它是两性氧化物 |
分析 A.依据原硅酸和硅酸的性质解答;
B.二氧化硅为原子晶体;
C.二氧化硅不溶于水;
D.二氧化硅能和碱反应生成盐和水,属于酸性氧化物.
解答 解:A.原硅酸是白色胶状物,受热失去部分水后变成白色粉末状硅酸,故A正确;
B.二氧化硅不是分子,故B错误;
C.二氧化硅不溶于水,与水不反应,故C错误;
D.SiO2与氢氟酸反应不生成盐和水,虽然SiO2既能与氢氟酸反应又能与NaOH溶液反应,但是SiO2不是两性氧化物,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉硅及其化合物性质是解题关键,注意两性氧化物的概念.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
6.下述实验不能能达到预期目的是( )
| 实验内容 | 实验目的 | |
| A | 向碳酸钠溶液中滴入几滴酚酞溶液 | 证明碳酸钠溶液呈碱性 |
| B | 取少量未知溶液于一只干净的试管中,向该溶液中逐渐滴入NaOH溶液直至过量 | 检验该溶液中是否含有Al3+ |
| C | 取未知溶液做焰色反应实验,并通过蓝色钴玻璃观看 | 检验该溶液中是否含有K+ |
| D | 取少量未知溶液,滴加新制的氯水,再滴加KSCN溶液 | 检验未知液中是否含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
11.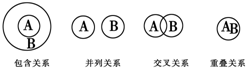 化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
 化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )| A. | 化合物与电解质属于重叠关系 | B. | 化合物与碱性氧化物属于交叉关系 | ||
| C. | 溶液与胶体属于并列关系 | D. | 离子化合物和电解质属于交叉关系 |
1.下列关于碳和硅的叙述中,不正确的是( )
| A. | +4价氧化物都能与氢氧化钠溶液反应 | |
| B. | 单质在加热时都能与氧气反应 | |
| C. | 氧化物都能溶于水生成相应的酸 | |
| D. | 碳和硅两种元素都有能导电的单质 |
8.A,B,C,D,E为原子序数依次增大的短周期主族元素,A与C,B与D分别同主族,且A,C元素的质子数之和是B、D元素质子数之和的一半,下列判断不正确的是( )
| A. | 原子半径大小顺序:C>D>B>A | |
| B. | 由B和C元素组成的化合物,可以既含有离子键,又含共价键 | |
| C. | 元素B、D、E分别与A形成的化合物中,熔沸点最高的是B与A形成的化合物 | |
| D. | 元素D与C形成的化合物在空气中长期放置不易变质 |
17.25℃时,下列有关电解质溶液中微粒的关系正确的是( )
| A. | pH=4的NaHSO3溶液中:c(SO32-)<c(H2SO3) | |
| B. | pH=3的氯化铵溶液与pH=3的盐酸中水的电离程度相同 | |
| C. | 将pH=5的醋酸溶液稀释后,所有离子浓度均减小,pH增大 | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
18.由短周期非金属元素X和元素Y组成的化合物Y2X3,已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n-3 | B. | n-1 | C. | n+5 | D. | n+2 |