题目内容
5.硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂,实验室可通过如下反应制取:2Na2S+Na2CO3+SO2=3Na2S2O3+CO2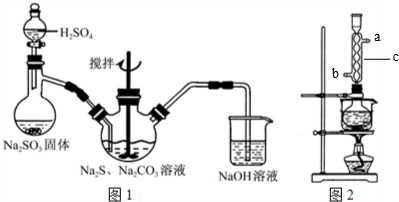
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是吸收SO2 等尾气,防止污染空气;如将分液漏斗中的H2SO4改成浓盐酸,则三颈瓶内除Na2S2O3生成外,还有NaCl(填化学式)杂质生成,
(2)为测定所得保险粉样品中Na2S2O3•5H2O的质量分数,Na2SO3固体可用标准溶液进行滴定,反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6
①KIO3、KI、和HCl可配制标准溶液,写出配制时发生反应的离子方程式IO3-+5I-+6H+=3I2+3H2O
②准确称取一定量的Na2S2O3•5H2O 样品于锥形瓶中,加水溶解,并滴加淀粉溶液作指示剂,用所配制的标准碘溶液滴定.滴定时所用的玻璃仪器除锥形瓶外,还有酸式滴定管
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品Na2S2O3•5H2O的质量分数的测量结果偏低(填“偏大”、“偏低”或“不变”)
(3)本实验对Na2S纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯,已知Na2S常温下微溶于酒精.加热时溶解度迅速增大,杂质不溶于酒精.
请补充完整下列提纯步骤:
①将已称好的工业Na2S放入圆底烧瓶中,并加入一定量的酒精和少量水:
②按图2所示装配仪器,向冷凝管中通入冷水,b进a出(用字母“a”“b”填空)
③待烧瓶中固体质量不再减少时,停止加热,将烧瓶取下;
④趁热过滤;
⑤将所得滤液冷却结晶,过滤;
⑥将所得固体洗涤、干燥,得到Na2S•9H2O.
分析 (1)尾气中含有未反应的二氧化硫,直接排放为污染空气;
制备二氧化硫中含有挥发出的HCl,HCl能与碳酸钠、硫化钠反应生成氯化钠;
(2)①KIO3、KI和HCl可配制标准碘溶液,KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘,还有水生成;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管;
③刚看到溶液局部变色就停止滴定,可能还没有达到滴定终点;
(3)②采取逆流原理通入冷凝水,使冷凝管内充满冷凝水充分冷却;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④温度增大硫化钠在酒精中溶解度增大,若冷却会析出硫化钠,应趁热过滤除去不溶物;
⑤热的滤液冷却结晶、过滤得到晶体.
解答 解:(1)尾气中含有未反应的二氧化硫,直接排放为污染空气,NaOH溶液的作用是:吸收SO2 等尾气,防止污染空气;
制备二氧化硫中含有挥发出的HCl,HCl能与碳酸钠、硫化钠反应生成氯化钠;
故答案为:吸收SO2 等尾气,防止污染空气;NaCl;
(2)①KIO3、KI和HCl可配制标准碘溶液,KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘,还有水生成,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管,
故答案为:淀粉溶液;酸式滴定管;
③刚看到溶液局部变色就停止滴定,可能还没有达到滴定终点,消耗的碘少,则浓度偏低,故答案为:偏低;
(3)②采取逆流原理通入冷凝水,使冷凝管内充满冷凝水充分冷却,则冷凝水应b进a出,故答案为:b;a;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下,故答案为:烧瓶中固体质量不再减少;
④温度增大硫化钠在酒精中溶解度增大,若冷却会析出硫化钠,应趁热过滤除去不溶物,故答案为:趁热过滤;
⑤热的滤液冷却结晶、过滤得到晶体,故答案为:将所得滤液冷却结晶,过滤.
点评 本题考查物质制备实验方案的设计,涉及对装置与原理的分析评价、物质的分离提纯、氧化还原反应滴定等,侧重于学生的分析能力、实验能力的考查,题目难度中等.

| A. | +4价氧化物都能与氢氧化钠溶液反应 | |
| B. | 单质在加热时都能与氧气反应 | |
| C. | 氧化物都能溶于水生成相应的酸 | |
| D. | 碳和硅两种元素都有能导电的单质 |
| A. | 原子半径大小顺序:C>D>B>A | |
| B. | 由B和C元素组成的化合物,可以既含有离子键,又含共价键 | |
| C. | 元素B、D、E分别与A形成的化合物中,熔沸点最高的是B与A形成的化合物 | |
| D. | 元素D与C形成的化合物在空气中长期放置不易变质 |
| A. | pH=4的NaHSO3溶液中:c(SO32-)<c(H2SO3) | |
| B. | pH=3的氯化铵溶液与pH=3的盐酸中水的电离程度相同 | |
| C. | 将pH=5的醋酸溶液稀释后,所有离子浓度均减小,pH增大 | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| A. | H2→H2O | B. | H+→H2 | C. | HClO→HCl | D. | ClO3-→Cl- |
 某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,其中绿球代表( )元素.
某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,其中绿球代表( )元素.