题目内容
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<O。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g)△H<O。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
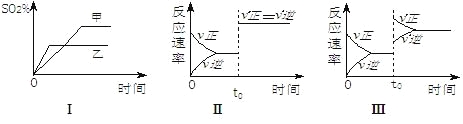
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻通入氦气对反应速率的影响
C.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
D.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
【答案】C
【解析】
A.图Ⅰ中乙到达平衡时间较短,乙的温度较高,正反应放热,升高温度,平衡向逆反应方向移动,SO2的转化率减小,乙的温度较高,故A错误;
B.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故B错误;
C.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故C正确;
D.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅲ改变条件瞬间,正、逆速率都增大,正反应速率增大较大,平衡向正反应移动,应是增大压强的原因,故D错误;
故答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①往盛有一定量CuCl2溶液的烧杯中逐滴加入NaOH溶液,直至不再产生沉淀,然后将烧杯中的物质转移到蒸发皿中,加热至沉淀全部变为黑色。
②将步骤①所得的黑色沉淀过滤、洗涤,晾干后研细备用。
(1)在实验过程中,若未加入NaOH溶液,直接将CuCl2溶液转移到蒸发皿中加热,最后也能得到黑色沉淀,试分析其原因__________。
(2)写出检验步骤②中沉淀是否洗涤干净的操作__________________。
(二)为证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用下图装置进行实验,每次实验时均收集25ml气体,其他可能影响实验的因素均已忽略,实验数据见下表:

实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
③ | 1.2g | 无其他物质 | a |
④ | 1.2g | CuO 0.5g | b |
⑤ | 1.2g | MnO20.5g | c |
(3)写出氯酸钾分解反应的化学方程式,并用双线桥表示电子转移的方向和数目________。
(4)上述实验中的“待测数据”是指___________________。
(5)图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装面成,此处用滴定管是________(填“酸式”或“碱式”)滴定管。
(6)若实验证明氧化铜加快氯酸钾的分解效果比用二氧化锰差,请结合上表的实验效果数据,在坐标图中分别画出使用CuO、MnO2作催化剂时产生氧气的体积[V(O2)]随时间(t)变化的曲线(注明必要的标识)________。