题目内容
【题目】用二氧化氯(ClO2)、高铁酸钠(Na2FeO4,摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)Na2FeO4之所以能净水、杀菌、消毒,原因是 。
(2)已知二氧化氯是一种黄绿色有刺激性气味的有毒气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。用下图所示的装置模拟工业制取及收集ClO2。
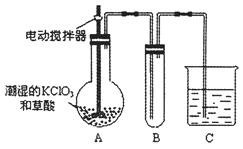
①A中反应产物有K2CO3、ClO2等,请写出反应方程式 。
②A部分还应添加温度控制装置,如水浴加热或酒精灯、温度计,B部分还应补充的装置为 (说明原因)。
③该装置按②补充完整后,装置A、B、C中还有一处设计明显不合理的是 (填“A”“B”或“C”),请画出正确的装置图。
④ClO2需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10ml,稀释成100ml试样;量取V1ml试样加入锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用cmol/LNa2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2ml。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
步骤2的目的 (用离子方程式表示)。当 时,可以判断此滴定操作达到终点;由以上数据可以计算原ClO2溶液的浓度为 g/L(用含字母的代数式表示)。
【答案】(1)①具有强氧化性(1分)②还原产物Fe3+发生水解生成Fe(OH)3胶体,能吸附悬浮物(1分)
(2)①2KClO3+H2C2O4![]() K2CO3+2ClO2↑+CO2↑+H2O
K2CO3+2ClO2↑+CO2↑+H2O
②冰水浴(或冷水浴)(1分)因为ClO2的沸点低,有利于凝聚收集(1分)
③C(1分)用球形干燥管(或者其他合理答案,例如防倒吸)(1分)
④8H++2ClO2+10I-=5I2+2Cl-+4H2O 溶液由蓝色变为无色,且半分钟内不变色 135cV2/V1gL-1
【解析】
试题分析:(1)+6价具有氧化性,所以Na2FeO4之所以能净水、杀菌、消毒,原因是①Na2FeO4具有强氧化性,起到杀菌、消毒的作用,②还原产物Fe3+发生水解生成Fe(OH)3胶体,能吸附悬浮物,达到净水的目的。
(2)①根据题意,工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得ClO2,A中反应产物有K2CO3、ClO2等,则发生反应的化学方程式为2KClO3+H2C2O4![]() K2CO3+2ClO2↑+CO2↑+H2O。
K2CO3+2ClO2↑+CO2↑+H2O。
②该实验的目的是模拟工业制取及收集ClO2,B装置是收集ClO2的装置,ClO2的熔点为-59℃,沸点为11.0℃,根据ClO2的性质,因为ClO2的沸点低,有利于凝聚收集,所以B部分还应补充的装置为冰水浴。
③C装置是尾气吸收装置,因为ClO2易溶于水,所以C处设计不合理;应该在导气管的末端接上用球形干燥管来防止倒吸。
④二氧化氯具有氧化性,能把碘化钾氧化生成单质碘,自身被还原为氯气,反应的方程式为8H++2ClO2+ 10I-=5I2+2Cl-+4H2O;由于碘遇淀粉显蓝色,所以终点的实验现象是滴加到最后一滴时,溶液由蓝色变为无色,且半分钟内不变色;设原ClO2溶液的浓度为x,根据离子方程式列关系式,则
2ClO2~5I2~~~~~~~~~~10Na2S2O3
2mol 10mol
(10-2x×V1×10-3)÷0.1 mol 1×10-3cV2mol
解得x=135cV2/V1gL-1

【题目】【高考改编】下列有关实验的操作正确的是( )
实验 | 操作 | |
A. | 测定溶液的pH | 用玻璃棒蘸取被测溶液点在湿润的pH试纸上 |
B. | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
C. | 实验室中的电器着火 | 用泡沫灭火器灭火 |
D. | 稀释浓硫酸 | 将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
【题目】为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准.表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数.结合表中列出的九种气体,试参与回答下列各题:
选项 | 物质 | 大气中的含量 (体积百分比) | 温室效应指数 |
A | H2 | 2 | 0 |
B | O2 | 21 | 0 |
C | H2O | 1 | 0.1 |
D | CO2 | 0.03 | 1 |
E | CH4 | 2×10﹣4 | 30 |
F | N2O | 3×10﹣5 | 160 |
G | O3 | 4×10﹣5 | 2000 |
H | CCl3F | 2.8×10﹣8 | 21000 |
I | CCl2F2 | 4.8×10﹣4 | 25000 |
(1)下列由极性键形成的极性分子是 .
A.N2 B.O2 C.H2O D.CO2E.CH4
(2)下列说法不正确的是 .
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3.CHClFCF3.C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 .
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的是 .
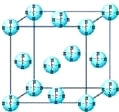
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH446H2O)是在低温高压下形成的晶体
(5)中钴离子在基态时核外电子排布式为: .
