题目内容
【题目】某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①往盛有一定量CuCl2溶液的烧杯中逐滴加入NaOH溶液,直至不再产生沉淀,然后将烧杯中的物质转移到蒸发皿中,加热至沉淀全部变为黑色。
②将步骤①所得的黑色沉淀过滤、洗涤,晾干后研细备用。
(1)在实验过程中,若未加入NaOH溶液,直接将CuCl2溶液转移到蒸发皿中加热,最后也能得到黑色沉淀,试分析其原因__________。
(2)写出检验步骤②中沉淀是否洗涤干净的操作__________________。
(二)为证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用下图装置进行实验,每次实验时均收集25ml气体,其他可能影响实验的因素均已忽略,实验数据见下表:

实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
③ | 1.2g | 无其他物质 | a |
④ | 1.2g | CuO 0.5g | b |
⑤ | 1.2g | MnO20.5g | c |
(3)写出氯酸钾分解反应的化学方程式,并用双线桥表示电子转移的方向和数目________。
(4)上述实验中的“待测数据”是指___________________。
(5)图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装面成,此处用滴定管是________(填“酸式”或“碱式”)滴定管。
(6)若实验证明氧化铜加快氯酸钾的分解效果比用二氧化锰差,请结合上表的实验效果数据,在坐标图中分别画出使用CuO、MnO2作催化剂时产生氧气的体积[V(O2)]随时间(t)变化的曲线(注明必要的标识)________。
【答案】CuCl2溶液中存在水解平衡CuCl2+ 2H2O![]() Cu(OH)2+ 2HCl,加热时HCl逸出使平衡不断右移,同时得到的Cu(OH)2受热分解生成CuO 取2~3mL最后的洗涤液于试管中,滴入少量稀硝酸酸化,再滴入几滴硝酸银溶液,若无白色沉淀产生,则洗涤干净
Cu(OH)2+ 2HCl,加热时HCl逸出使平衡不断右移,同时得到的Cu(OH)2受热分解生成CuO 取2~3mL最后的洗涤液于试管中,滴入少量稀硝酸酸化,再滴入几滴硝酸银溶液,若无白色沉淀产生,则洗涤干净  收集25 mL气体所需的时间 碱式
收集25 mL气体所需的时间 碱式 
【解析】
(1)CuCl2是强酸弱碱盐会发生水解,CuCl2溶液中存在水解平衡CuCl2+ 2H2O![]() Cu(OH)2+ 2HCl,水解吸热,加热时HCl逸出使平衡不断右移,同时得到的Cu(OH)2受热分解生成CuO。
Cu(OH)2+ 2HCl,水解吸热,加热时HCl逸出使平衡不断右移,同时得到的Cu(OH)2受热分解生成CuO。
(2)如果没有洗涤干净则有NaCl杂质,检验是否有Cl—即可确定是否洗净,具体操作是:取2~3mL最后的洗涤液于试管中,滴入少量稀硝酸酸化,再滴入几滴硝酸银溶液,若无白色沉淀产生,则洗涤干净。
(3)用双线桥表示电子转移的方向和数目时,线桥要从反应物指向生成物的化合价发生改变的同种元素,在线桥上要注明反应的得失电子数目,用双线桥表示氯酸钾分解的电子转移的方向和数目为: 。
。
(4)要比较反应的快慢需要反应的时间,因此待测数据是:收集25 mL气体所需的时间。
(5)从图可以看出该滴定管没有活塞,所以是碱式滴定管。
(6)反应测的是收集25 mL气体所需的时间,所以气体的体积要相等,氧化铜加快氯酸钾的分解效果比用二氧化锰差,所以用氧化铜做作催化剂所用的时间要多,产生氧气的体积[V(O2)]随时间(t)变化的曲线为: 。
。

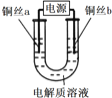
【题目】某小组同学用如下装置电解食盐水,并对电解产物进行探究。
实验装置 | 电解质溶液 | 实验现象 | |
|
| a极附近 | b极附近 |
开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
资料显示:
①氯化亚铜(CuCl)为白色粉末,微溶于水;
②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的![]() ;
;
③![]() 水溶液中不稳定,酸性条件下易歧化为
水溶液中不稳定,酸性条件下易歧化为![]() 和Cu;
和Cu;
④氢氧化铜可以溶于浓NaOH得到蓝色溶液.
![]() 经检验,b极产生的气体是
经检验,b极产生的气体是![]() ,b极附近溶液的pH______
,b极附近溶液的pH______![]() 填“增大”、“减小”、或“不变”
填“增大”、“减小”、或“不变”![]() ;铜丝a应与电源的______
;铜丝a应与电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极相连。
极相连。
![]() 同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是______。
同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是______。
![]() ①橙黄色沉淀中含有
①橙黄色沉淀中含有![]() ,则CuCl转化为
,则CuCl转化为![]() 的原因是______
的原因是______![]() 用方程式表示
用方程式表示![]() ;
;
②结合离子在溶液中的运动规律,解释“
![]() 同学们通过实验进一步证实沉淀中含有
同学们通过实验进一步证实沉淀中含有![]() :将橙黄色沉淀滤出洗涤后,滴加
:将橙黄色沉淀滤出洗涤后,滴加![]()
![]() 至过量,应观察到的现象是______。
至过量,应观察到的现象是______。
![]() 同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为
同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为![]() 。为此,他们用Cu电极电解
。为此,他们用Cu电极电解![]() NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:______。
NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:______。
【题目】I .甲、乙、丙3位同学,在已知盐酸是强酸的基础上,通过实验验证醋酸是弱酸,分别设计了如下实验方案:
甲:分别准确配制0.1 mol/L的盐酸和醋酸各250 mL,再用pH试纸分别测定两溶液的pH。
乙:分别准确配制0.1 mol/L的盐酸和醋酸各250 mL。各取出20 mL于锥形瓶中,逐滴加入0.1 mol/L标准NaOH溶液(不需配制),分别记录恰好中和时用去NaOH溶液的体积。
丙:分别准确配制pH=1的盐酸和醋酸各250 mL。各取出10 mL加水稀释到100 mL后比较稀释后溶液的pH。回答下列问题:
(1)甲同学的实验结果为盐酸和醋酸的pH分别为pH1和pH2,则pH1_____pH2(填“>”“<”或“=”),所以此实验方案________(填“可行”或“不可行”)。
(2)乙同学的实验结果为盐酸和醋酸分别用去NaOH溶液V1 mL和V2 mL,则V1____V2(填“>”“<”或“=”),所以此实验方案______(填“可行”或“不可行”)。
(3)丙同学的实验方案不可行的原因是____________________________________。
II. 测定Na2S2O3样品纯度。
取10.0 g Na2S2O3·5H2O样品,配成 250mL溶液,准确量取25.00 mL溶液,以淀粉作指示剂,用0.1000 mol·L-1碘的标准溶液滴定。三次平行实验测得的数据如下:
实验序号 | 消耗标准溶液体积/mL |
1 | 19.98 |
2 | 17.90 |
3 | 18.10 |
已知:2Na2S2O3+I2=Na2S4O6+2NaI
①滴定终点的颜色为__________________。
②该Na2S2O3·5H2O样品的纯度为___%(保留2位小数)(已知Na2S2O3·5H2O的M=248g mol·-1)。
③若样品中含Na2SO3(还原性:SO32->I-),则测得的结果_______(填“偏高”“偏低”或“无影响”)