题目内容
【题目】请回答下列问题:
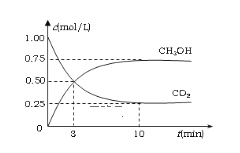
(1)在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g) △H =-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+ H2O(g) △H =-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①氢气的转化率=__________________;
②该反应的平衡常数为___________(保留小数点后2位);
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
④当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1______c2的关系(填>、<、=)。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
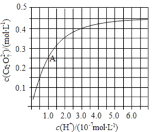
(3)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72) 随c(H+)的变化如图所示。①离子方程式表示Na2CrO4溶液中的转化反应_________________。②由图可知,溶液酸性增大,CrO42的平衡转化率____(填“增大“减小”或“不变”)。
【答案】75% 5.33 C、D < 光能转化为化学能 2CrO42-+2H+![]() Cr2O72-+H2O 增大
Cr2O72-+H2O 增大
【解析】
(1) ① 根据图示,达到平衡时,甲醇浓度的变化量为0.75 mol·L-1,则氢气浓度的变化量为2.25 mol·L-1;②利用“三段式”计算平衡常数;③平衡正向移动,能使平衡体系中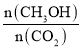 增大;④根据勒夏特列原理分析;
增大;④根据勒夏特列原理分析;
(2) 利用太阳能直接分解水制氢,把太阳能转化为化学能储存起来。
(3)根据图示,氢离子浓度越大,CrO42转化为Cr2O72的越多。
(1) ① 根据图示,达到平衡时,甲醇浓度的变化量为0.75 mol·L-1,则氢气浓度的变化量为2.25 mol·L-1,所以氢气的转化率=![]() 75% ;
75% ;
② CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
开始 1 3 0 0
转化 0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
![]() 5.33;
5.33;
③A.CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g)正反应放热,升高温度,平衡逆向移动,
CH3OH(g)+ H2O(g)正反应放热,升高温度,平衡逆向移动,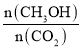 减小,故不选A;
减小,故不选A;
B.充入He(g),使体系压强增大,反应体系各物质浓度不变,平衡不移动,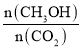 不变,故不选B;
不变,故不选B;
C.将H2O(g)从体系中分离出去,水浓度减小,平衡正向移动,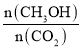 增大,故选C;
增大,故选C;
D.再充入1mol CO2和3mol H2,相当于加压,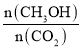 增大,故选D;
增大,故选D;
④当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,氢气浓度增大,平衡正向移动,根据勒夏特列原理,平衡移动减弱这种改变,但不消除这种改变,待反应再一次达到平衡后,H2的物质的量浓度c2>c1;
(2) 利用太阳能直接分解水制氢,把太阳能转化为化学能,其能量转化形式为光能转化为化学能。
(3) Na2CrO4在溶液中的转化反应为2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
根据图示,氢离子浓度越大, Cr2O72的浓度越大,所以溶液酸性增大,CrO42的平衡转化率增大。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】下列表格中的各种情况,可以用对应选项中的图像表示的是
选项 | 反应 | 甲 | 乙 |
A | 外形、大小相近的金属和水反应 | Na | K |
B | 4mL0.01mol·L-1 KMnO4溶液分别和不同浓度的2mLH2C2O4(草酸)溶液反应 | 0.1mol·L-1的H2C2O4溶液 | 0.2mol·L-1的H2C2O4溶液 |
C | 5mL0.1mol·L-1Na2S2O3溶液和5mL0.1mol·L-1H2SO4溶液反应 | 热水 | 冷水 |
D | 5mL4%的过氧化氢溶液分解放出O2 | 无MnO2粉末 | 加MnO2粉末 |
A.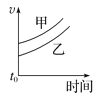 B.
B.
C. D.
D.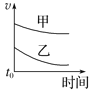
【题目】请按下列要求填空:
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因___________________________________。
(2)广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是 ___________
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -b kJ/mol
③ H2O(g)= H2O(l) ΔH3 = -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______。
A.HCN B.HClO C.CH3COOH D.H2CO3