题目内容
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
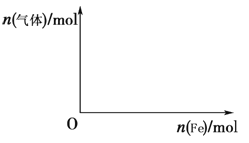
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是___________。判断L1、L2的大小关系,并简述理由:_________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________(填“>”、“<”或 “=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =_____________。(保留一位小数)
【答案】2NO(g)+2CO(g) =N2(g)+2CO2(g) △H =746.5 kJ·mol1 2.25 ×104 温度 L2>L1;该反应为气体体积减小的反应,相同温度下压强增大,NO转化率增大 < 0.5
【解析】
(1)根据盖斯定律进行计算;
(2)平均反应速率为![]() ,反应为放热反应,正反应气体体积减小,根据勒夏特列原理进行分析;
,反应为放热反应,正反应气体体积减小,根据勒夏特列原理进行分析;
(3)反应平衡时,正反应速率等于逆反应速率,物质浓度为反应平衡时的物质的量,不是反应变化量,据此进行计算。
(1)根据盖斯定律,CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是2NO(g)+2CO(g) =N2(g)+2CO2(g) △H =2△H1 -△H2 -△H3 =746.5 kJ·mol1。
(2)① 根据图表可知,前4 s内一氧化碳的浓度变化为0.9×103mol·L1,平均反应速率υ(CO) =![]() mol·L1·s1。
mol·L1·s1。
② L、X可分别代表压强或温度。根据上述热反应方程式可知,反应为放热反应,正反向的气体体积减小。若在同样L条件下,X增大,一氧化氮的转化率下降,说明X为温度,即L为压强。在同温条件下,L2的转化率高于L1,该反应为气体体积减小的反应,相同温度下压强增大,NO转化率增大,L2>L1。
(3)①达到平衡后,仅升高温度,正反应为放热反应,反应逆向移动,k正增大的倍数<k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,即反应消耗了0.4mol一氧化碳,0.4mol一氧化氮,生成了0.4mol二氧化碳和0.2mol氮气,到达平衡时v正v逆,即k正·c2(NO)·c2(CO)=k逆·c(N2) ·c2(CO2),则k正︰k逆=![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下表为部分短周期元素化合价及相应原子半径的数据:
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
最低化合价 | ﹣2 | ﹣3 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣1 | 0 |
已知:①A与D可形成化合物AD2、AD3,②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)用电子式表示A的氢化物与足量H 的最高价氧化物对应水化物反应生成的盐的形成过程:____________________________________________________________;
(2)E的简单气态氢化物极易溶于水的原因有:①_____________________________;
②____________________________________________。
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_______________。
(4)将标准状况下40L无色气体ED与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式_______________________。