��Ŀ����
����Ŀ���±�Ϊ���ֶ�����Ԫ�ػ��ϼۼ���Ӧԭ�Ӱ뾶�����ݣ�
Ԫ������ | Ԫ�ر�� | |||||||
A | B | C | D | E | F | G | H | |
ԭ�Ӱ뾶(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
����ϼ� | +6 | +5 | +4 | +5 | +7 | +1 | ||
��ͻ��ϼ� | ��2 | ��3 | ��4 | ��2 | ��3 | ��1 | ��1 | 0 |
��֪����A��D���γɻ�����AD2��AD3����E��D���γɶ��ֻ��������ED��ED2�dz����Ļ����C�������ƹ��ء�
(1)�õ���ʽ��ʾA���⻯��������H ������������Ӧˮ���ﷴӦ���ɵ��ε��γɹ��̣�____________________________________________________________��
(2)E�ļ���̬�⻯�K������ˮ��ԭ���У���_____________________________��
��____________________________________________��
(3)�������ΪADG2��������ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᡣ�÷�Ӧ�Ļ�ѧ����ʽ��_______________��
(4)����״����40L��ɫ����ED��15L����ͨ��һ��Ũ�ȵ�NaOH��Һ�У�ǡ�ñ���ȫ���գ�ͬʱ���������Ρ���д���÷�Ӧ�����ӷ���ʽ_______________________��
���𰸡�![]() �������Ǽ��Է��ӣ�ˮ�Ǽ����ܼ�������������ԭ����֪������������ˮ NH3��H2O���Ӽ��γ�����������˰������ܽ�� SOCl2��H2O��2HCl��SO2�� 8NO + 3O2 + 8OH- = 2NO3-+6NO2- + 4H2O��
�������Ǽ��Է��ӣ�ˮ�Ǽ����ܼ�������������ԭ����֪������������ˮ NH3��H2O���Ӽ��γ�����������˰������ܽ�� SOCl2��H2O��2HCl��SO2�� 8NO + 3O2 + 8OH- = 2NO3-+6NO2- + 4H2O��
��������
������Ԫ�أ�A��D����ͻ��ϼ�-2�����ڵڢ�A�壬A����ϼ�+6����Aԭ�Ӱ뾶�ϴ�AΪSԪ�أ�DΪOԪ�أ�B��E�����������+5�������-3�����ڢ�A�壬B��ԭ�Ӱ뾶�ϴ���BΪPԪ�ء�EΪNԪ�أ�C�������+4�������-4�����ڢ�A�壬ԭ�Ӱ뾶�ϴ���CΪSiԪ�أ�F��G������ͻ��ϼ�-1�����ڢ�A�壬G����������ϼ�+7����ԭ�Ӱ뾶�ϴ���FΪFԪ�ء�GΪClԪ�أ�H��������ϼ�Ϊ+1��ԭ�Ӱ뾶����Si�����HΪNaԪ�أ��Դ������
(1) AΪSԪ�أ����⻯��ΪH2S��HΪNaԪ�أ�������������Ӧˮ����ΪNaOH�� H2S������NaOH��Ӧ���ɵ���ΪNa2S���õ���ʽ��ʾNa2S���γɹ���Ϊ��![]() ��
��
��2��E�ļ���̬�⻯��NH3��������ˮ��ԭ���Ǣٰ������Ǽ��Է��ӣ�ˮ�Ǽ����ܼ�������������ԭ����֪������������ˮ����NH3��H2O���Ӽ��γ�����������˰������ܽ�ȣ�
��3���������ΪACH2��������SOCl2����ˮ�л�ǿ��ˮ�⣬����ʹƷ����Һ��ɫ����ɫ�����һ��ǿ�ᣬ���Ը�������SO2������ԭ���غ��֪��ǿ��Ӧ�������ᣬ���Ը÷�Ӧ�Ļ�ѧ����ʽ��SOCl2��H2O��2HCl��SO2����
��4��EDΪNO������������40L:15L=8:3�ı�����Ӧ����Ӧ�����ӷ���ʽΪ��8NO + 3O2 + 8OH-��2NO3-+6NO2- + 4H2O��

����Ŀ����һ��Һ����ȷ���Ƿ����������ӣ�K����Mg2����Fe3����Ba2����SO42-��Cl����I����HCO3-��ʵ�����£�
ʵ�鲽�� | ʵ������ |
���ò�����պȡ��������Һ������pH��ֽ�в� | ��ֽ��Ϊ��ɫ |
��ȡ��������Һ������BaCl2��Һ | �а�ɫ�������� |
��ȡ���з�Ӧ����ϲ���Һ������AgNO3��Һ | ���ȶ��İ�ɫ�������ɣ��Ҳ�����ϡ���� |
��ȡ��������Һ������NaOH��Һ | ֻ�к��ɫ�������� |
�����ж���ȷ���ǣ�������
A.��Һ��������ֻ��Fe3��
B.����û��Na������ɫ��Ӧ�۲�K��ʱ��������ɫ���ܲ���
C.����û�в���٣�Ҳ��Ӱ����Һ�����ӵ��ж�
D.����ܷ�����Ӧ�����ӷ���ʽֻ�У�Fe3����3OH��=Fe��OH��3��
����Ŀ���������ŷŵ���Ⱦ����Ҫ��̼�⻯���һ����̼�͵�������ȡ�
I������ȼ�ͳ��ϰ�װ��Ԫ��ת����������Ч��������β����Ⱦ��
��1����֪�� C��s��+O2��g�� = CO2��g�� ��H1 �� 393.5kJ��mol1
2C��s��+O2��g�� = 2CO��g�� ��H2 �� 221.0 kJ��mol1
N2��g��+O2��g�� = 2NO��g�� ��H 3 ��+180.5 kJ��mol1
CO��NO����β���ڴ�������������N2���Ȼ�ѧ����ʽ��_______��
��2���о�CO��NO�Ĵ���Ӧ�������崫���������ij�¶��¡�һ��������ܱ������У���ͬʱ��NO��COŨ�����±���
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��NO��/��104mol��L1�� | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c��CO��/��103mol��L1�� | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
�� ǰ4 s�ڵ�ƽ����Ӧ��������CO�� ��______mol��L1��s1��
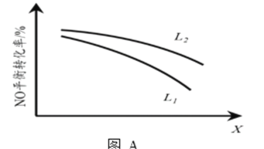
�� L��X�ɷֱ����ѹǿ���¶ȡ���ͼA��ʾLһ��ʱ��NO��g����ƽ��ת������X�ı仯��ϵ��X��������������___________���ж�L1��L2�Ĵ�С��ϵ�����������ɣ�_________��
��3��ʵ���ã�v��=k����c2��NO����c2��CO����v��=k����c��N2�� ��c2��CO2����k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٴﵽƽ��������¶ȣ�k������ı���_________������>������<���� ��=����k������ı�����
������2 L���ܱ������г���1 mol CO��1 mol NO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ40%����k���Uk�� =_____________��������һλС����