题目内容
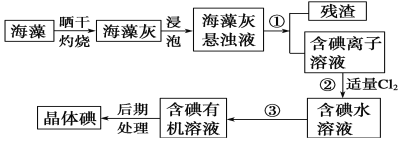
【题目】工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:
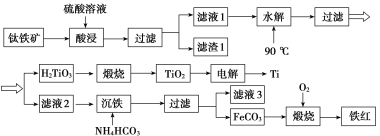
已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O![]() ===S4O
===S4O![]() +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
【答案】升温、搅拌、适当增大硫酸浓度、粉碎矿石 TiO2++2H2O=H2TiO3↓+2H+ ![]() 温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗
温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗 ![]()
【解析】
根据流程:用硫酸酸浸钛铁矿(主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2等杂质),SiO2不溶,钛酸亚铁、氧化镁溶解,过滤,滤渣1为SiO2,滤液1含有Fe2+、TiO2+、Mg2+,水解滤液1发生反应:TiO2++2H2O=H2TiO3↓+2H+,过滤得到H2TiO3,煅烧H2TiO3得到TiO2,电解得到Ti;滤液2主要含有Fe2+、Mg2+,加入碳酸氢铵沉铁反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,得到FeCO3沉淀和含有Mg2+的滤液3,FeCO3与氧气煅烧得到铁红,据此分析作答。
(1)适当升温。搅拌、适当增大六三浓度、粉碎矿石等可以提高浸取速度和浸取率;
(2)根据分析,滤液1含有TiO2+,水解生成H2TiO3,离子反应为:TiO2++2H2O=H2TiO3↓+2H+;
(3)“沉铁”过程中生成的气体是二氧化碳,其电子式为![]() ;温度过高溶液导致碳酸氢铵分解(或防止Fe2+、Mg2+等受热水解),过沉铁过程过程需控制反应温度低于35℃;
;温度过高溶液导致碳酸氢铵分解(或防止Fe2+、Mg2+等受热水解),过沉铁过程过程需控制反应温度低于35℃;
(4)已知:Ksp[Mg(OH)2]=1.0×10-11,使Mg2+恰好沉淀完全,此时c(OH-)= ![]() mol/L=1.0×10-3mol/L,c(H+)=1.0×10-11mol/L,故pH≥11,Mg2+沉淀完全;
mol/L=1.0×10-3mol/L,c(H+)=1.0×10-11mol/L,故pH≥11,Mg2+沉淀完全;
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒,阳极反应为:2O2--4e-=O2↑,阳极产生的氧气与石墨反应生成二氧化碳,导致阳极损耗,故阳极石墨棒需要定期更换;
(6)铁红溶于稀硫酸得到Fe3+,与KI发生反应:2Fe3++2I-=2Fe2++I2,用硫代硫酸钠(Na2S2O3)标准液滴定生成的碘,有关系式:Fe2O3~2Fe3+~I2~2Na2S2O3,则n(Fe2O3)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() cV×10-3mol,故mg样品中铁红产品的纯度为
cV×10-3mol,故mg样品中铁红产品的纯度为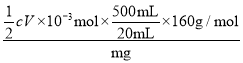 ×100%=
×100%=![]() 。
。

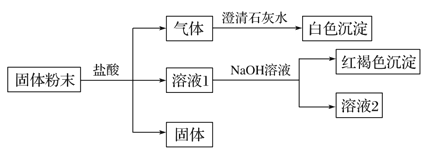
【题目】有一溶液,欲确定是否含有下列离子:K+、Mg2+、Fe3+、Ba2+、SO42-、Cl-、I-、HCO3-,实验如下:
实验步骤 | 实验现象 |
①用玻璃棒蘸取少量该溶液,点在pH试纸中部 | 试纸变为红色 |
②取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
③取②中反应后的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
④取少量该溶液,加入NaOH溶液 | 只有红褐色沉淀生成 |
下列判断正确的是( )
A.溶液中阳离子只有Fe3+
B.由于没有Na+,焰色反应观察K+时不必用蓝色的钴玻璃
C.假如没有步骤①,也不影响溶液中离子的判断
D.步骤④发生反应的离子方程式只有:Fe3++3OH-=Fe(OH)3↓
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是___________。判断L1、L2的大小关系,并简述理由:_________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_________(填“>”、“<”或 “=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =_____________。(保留一位小数)