题目内容
6.以下实验能获得成功的是( )| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将电石与水直接混合可以平稳快速制备乙炔 | |
| D. | CCl4加入盛碘水的分液漏斗中振荡、静置,从下口放出紫红色溶液 |
分析 A.应防止生成的AgOH或AgO沉淀影响实验结果;
B.金属作电解池的阴极被保护;
C.电石与水反应较快;
D.CCl4密度比水大.
解答 解:A.在碱性条件下水解,应先调节溶液呈酸性,以防止生成的AgOH或AgO沉淀影响实验结果,故A错误;
B.金属作电解池的阴极被保护,则把钢闸门与外加电源的负极连接就可以被保护,故B错误;
C.实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流,故C错误;
D.碘单质溶于CCl4层显紫色,CCl4密度比水大,从下口放出,故D正确.
故选D.
点评 本题考查物质的检验、制备、分离提纯等,侧重于学生的分析能力和实验能力的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.木糖(又称戊醛糖,结构简式为CH2OH((CHOH)3CHO,性质与葡萄糖相似)是一种存在于木屑、稻草、玉米芯等的五碳糖,下列有关说法不正确的是( )
| A. | 从结构上推断,木糖分子中有多个羟基,因而能溶于水 | |
| B. | 木糖属于单糖 | |
| C. | 木糖属还原性糖,1mol木糖与足量的银氨溶液完全反应可生成108g银 | |
| D. | 木糖能发生酯化、氧化、加成等反应 |
17.判断下列化合物的化学键的类型,并根据化学键类型归类化合物类型;
| 微粒符号 | 化学键类型 | 化合物类型 |
| HCl | 共价键 | 共价键化合物 |
| NaCl | 离子键 | 离子化合物 |
| NaOH | 离子键和共价键 | 离子化合物 |
| NH4Cl | 离子键和共价键 | 离子化合物 |
14.下列离子方程式正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| B. | 氢氧化钡与稀硫酸混合:SO42-+H++OH-+Ba2+=H2O+BaSO4↓ | |
| C. | 用稀硫酸洗去铁锈:Fe2O3+6H+=2 Fe3++3H2O | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
1.下列说法正确的是( )
| A. | 实验室制备用盐酸制H2,可用排饱和碳酸氢钠溶液除氯化氢 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入硝酸钠固体,铜粉仍不溶 | |
| C. | CaCl2、NaOH、HCl、HD四种物质都属于化合物 | |
| D. | Cl2具有很强的氧化性,但在化学反应中可能作还原剂 |
18.下列关于元素周期表的叙述正确的是( )
| A. | 元素周期表有7个主族和8个副族 | B. | ⅣA族的元素全部是非金属元素 | ||
| C. | 元素周期表有7个周期 | D. | 短周期指第1、2周期 |
15.下列关于化学反应限度的说法中正确的是( )
| A. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 | |
| B. | 化学反应的限度不可以通过改变条件而改变 | |
| C. | 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| D. | 当一个可逆反应达到平衡状态时,那么这个反应的正反应速率和逆反应速率为零 |
16.下列变化属于吸热反应的是( )
| A. | 将胆矾加热变成白色粉末 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | 干冰升华 | D. | 生石灰与水反应生成熟石灰 |
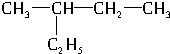 和
和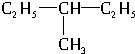
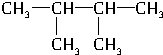 和
和