题目内容
1.下列说法正确的是( )| A. | 实验室制备用盐酸制H2,可用排饱和碳酸氢钠溶液除氯化氢 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入硝酸钠固体,铜粉仍不溶 | |
| C. | CaCl2、NaOH、HCl、HD四种物质都属于化合物 | |
| D. | Cl2具有很强的氧化性,但在化学反应中可能作还原剂 |
分析 A.盐酸和碳酸氢钠反应生成二氧化碳;
B.铜和硝酸能反应;
C.HD是单质;
D.氯气与水、碱的反应中,既为氧化剂又是还原剂.
解答 解:A.盐酸和碳酸氢钠反应生成二氧化碳,引入新的杂质,故A错误;
B.铜和稀硫酸不反应,加入硝酸钠溶液中稀硝酸具有强氧化性能氧化铜,铜粉溶解,故B错误;
C.HD是氢元素的同位素原子形成的单质,故C错误;
D.氯气与水、碱的反应中,只有Cl元素化合价发生变化,既为氧化剂又是还原剂,故D正确.
故选D.
点评 本题考查常见的概念、物质的除杂和性质,题目难度不大,了解常见物质的组成、抓住各概念的特征进行分析判断是解答此类题的关键,采用排除法是正确、快速解答此类题的捷径.

练习册系列答案
相关题目
17.某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.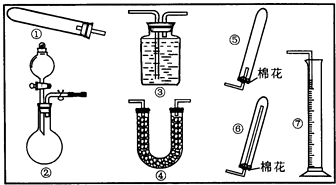
(1)若用装置①制取NH3,其反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
若要测定生成的NH3的体积,则必须选择的装置是③⑦(填装置序号),装置中所盛试剂应具有的性质是氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发.
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是CaO或(NaOH或碱石灰),分液漏斗中装的试剂是浓氨水(或浓NH4Cl溶液),收集装置应选择⑥(填装置序号).
证明氨气已收集满的操作是用湿润的红色石蕊试纸靠近管口,若试纸变蓝则证明已收集满
检验装置②的气密性的方法是在橡胶管处接上导气管,关闭分液漏斗活塞,打开止水夹,将导气管末端插入水槽中,用热毛巾捂着烧瓶(或用酒精灯微热),导气管末端有气泡冒出,移开热毛巾(或停止加热)一段时间,导气管末端有一段水柱(或关闭装置②的止水夹和分液漏斗活塞,从分液漏斗的上端注入一定量的水,打开分液漏斗活塞,若漏斗中的水滴入烧瓶中的速率逐渐减慢至不再滴入,说明装置气密性良好)
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积
(标准状况)如下表:
从表中数据分析,实验室制氨气的产率最高的⑥其原因是因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用Ca(OH)2反应产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高.

(1)若用装置①制取NH3,其反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
若要测定生成的NH3的体积,则必须选择的装置是③⑦(填装置序号),装置中所盛试剂应具有的性质是氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发.
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是CaO或(NaOH或碱石灰),分液漏斗中装的试剂是浓氨水(或浓NH4Cl溶液),收集装置应选择⑥(填装置序号).
证明氨气已收集满的操作是用湿润的红色石蕊试纸靠近管口,若试纸变蓝则证明已收集满
检验装置②的气密性的方法是在橡胶管处接上导气管,关闭分液漏斗活塞,打开止水夹,将导气管末端插入水槽中,用热毛巾捂着烧瓶(或用酒精灯微热),导气管末端有气泡冒出,移开热毛巾(或停止加热)一段时间,导气管末端有一段水柱(或关闭装置②的止水夹和分液漏斗活塞,从分液漏斗的上端注入一定量的水,打开分液漏斗活塞,若漏斗中的水滴入烧瓶中的速率逐渐减慢至不再滴入,说明装置气密性良好)
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积
(标准状况)如下表:
| 试剂组合/NH3体积(mL) | 6.0gCa(OH)2(s,过量) | 6.0NaOH(s,过量) | 6.0g CaO(s,过量) |
| 5.4g NH4Cl(s) | ①/1344 | ②/1568 | ③/1792 |
| 5.4(NH4)2SO4(s) | ④1364 | ⑤1559 | ⑥/1753 |
12.下列物质中碱性最强的是( )
| A. | LiOH | B. | NaOH | C. | Mg(OH)2 | D. | Al(OH)3 |
9.一定温度下,将 2mol SO2 和 1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
| A. | 生成SO3为2 mol | |
| B. | 反应放出197 kJ 的热量 | |
| C. | SO2和SO3物质的量之和一定为2mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
16.在两个密闭容器中,分别充有质量相同的甲乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是( )
| A. | 若M(甲)>M(乙),则气体体积:甲<乙 | |
| B. | 若M(甲)<M(乙),则气体压强:甲>乙 | |
| C. | 若M(甲)>M(乙),则气体的摩尔体积:甲>乙 | |
| D. | 若M(甲)<M(乙),则分子数:甲<乙 |
6.以下实验能获得成功的是( )
| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将电石与水直接混合可以平稳快速制备乙炔 | |
| D. | CCl4加入盛碘水的分液漏斗中振荡、静置,从下口放出紫红色溶液 |
13.下列物质中既含有离子键又含有共价键的化合物是( )
| A. | NaCl | B. | N2 | C. | KOH | D. | SO2 |
10.丙烯醛的结构简式为CH2=CH-CHO.下列有关于它性质的叙述中错误的是( )
| A. | 能使溴水褪色,也能使高锰酸钾酸性溶液褪色 | |
| B. | 在一定条件下与H2充分反应,生成1-丙醇 | |
| C. | 能发生银镜反应表现出氧化性 | |
| D. | 在一定条件下能被空气氧化 |
11.下列离子方程式中,书写正确的是( )
| A. | 碳酸氢钠溶液中加入过量的石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用碳酸钠溶液吸收足量二氧化硫:2CO32-+2SO2+H2O═2HCO3-+SO32- | |
| D. | 在FeBr2溶液中通入足量的Cl2气体:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 |