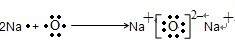
题目内容
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
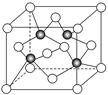
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
(写出计算过程)
(1)A、B、C、D的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)化合物BD3的分子空间构型是 。
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为 。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是 。

A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为 。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
(写出计算过程)
(1)Na<S<P<Cl (2)三角锥形(3)① 4 ②正四面体 ③BCD ④SP2 ⑤ 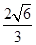
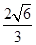
试题分析:B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的,这说明该元素应该是第ⅤA族的P元素。D原子得到一个电子后3P轨道全充满,所以D是氯元素。A+比D原子形成的离子少一个电子层,所以A是Na元素。C与A形成A2C型离子化合物,且C的原子序数大于B的,因此C是S元素。E的原子序数为31,则E是Ga。F与B属同一主族,且E的原子序数大于F的,所以F是砷元素。
(1)非金属性越强,第一电离能越大。但由于P原子的3p轨道电子处于半充满状态,稳定性强,所以第一电离能大于硫元素的,则A、B、C、D的第一电离能由小到大的顺序为Na<S<P<Cl。
(2)化合物BD3分子中中心原子P原子含有1对孤对电子,所以分子空间构型是三角锥形。
(3)①该晶胞中所包含的F原子(白色球)个数为8×1/8+6×1/2=4个。
②根据晶胞结构可知,与同一个E原子相连的F原子构成的空间构型为正四面体型结构。
③氯化钠是的配位数是6个,该晶胞结构与NaCl不相同,所以选项A不正确;原子数和价电子数分别都相等的是等电子体,则选项B正确;非金属性越强,电负性越大,则选项C正确;As原子含有孤对电子,所以可以形成配位健,选项D正确,答案选BCD。
④ (CH3)3E分子是平面型结构,所以中心E原子的杂化方式为sp2杂化。
⑤根据晶胞结构可知,以E原子为中心,4个F原子构成正四面体,所以该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
设晶胞参数为a,则紧邻的As原子核间距为2倍As原子半径,即
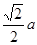 。而紧邻As、Ga间距离请想象一个正方体内接正四面体,经过简单计算可知正四面体体心为正方体体心,位于正方体体对角线中点处。把上述晶胞拆成8个等大的小立方体,可以发现其中4个的体心位置有Ga原子填充。小立方体的棱长为0.5a,则其体对角线长是
。而紧邻As、Ga间距离请想象一个正方体内接正四面体,经过简单计算可知正四面体体心为正方体体心,位于正方体体对角线中点处。把上述晶胞拆成8个等大的小立方体,可以发现其中4个的体心位置有Ga原子填充。小立方体的棱长为0.5a,则其体对角线长是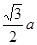 ,可得As、Ga间距为
,可得As、Ga间距为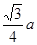 ,综上所诉,该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
,综上所诉,该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为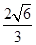 。
。点评:该题是高考中的常见题型和考点,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力、自学能力和知识的迁移能力,提高学生灵活运用基础知识解决实际问题的能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目